
已知氧化性:Br2>Fe3+>I2;还原性:I->Fe2+>Br-,则下列反应能发生的是( )
A.I2+2Fe2+===2Fe3++2I- B.2Br-+I2===Br2+2I-
C.2Fe3++2I-===2Fe2++I2 D.2Fe3++2Br-===2Fe2++Br2
科目:高中化学 来源: 题型:
有0.1mol·L-1的三种溶液:①CH3COOH ②NaOH ③CH3COONa,下列说法正确的是( )
A.溶液①中,c(CH3COO-)=c(H+)
B.溶液①②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-)
C.溶液①②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+)
D.溶液①③等体积混合,混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个固定体积的密闭容器中,加入2molA和1molB,发生反应:
2A(气) + B(气)  3C(气) + D(气)
3C(气) + D(气)
达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
A. 4molA+2molB B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB D. 3molC+1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应
PH4I(S) PH3(g) + HI(g) ① ;
4PH3(g) P4(g)+ 6 H2(g) ② ;
2HI(g) H2(g) + I2(g) ③
以上三反应建立平衡后,测得HI为b mol,I2(气)为c mol,H2为d mol。求:
⑴ 平衡后,容器内P4(气)和PH3的物质的量(用代数式表示):n(P4)= ,n(PH3)= 。
⑵ a,b,c三者的关系服从a > (填含b,c的代数式)。
⑶ 平衡后,增大压强,容器内n(I2) , n(PH4I) (增加、减少、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
分类是化学学习与研究的常用方法,下列分类正确的是( )
A.非金属氧化物均属于酸性氧化物
B.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
C.根据电解质的水溶液导电性的强弱,将电解质分为强电解质和弱电解质
D.根据反应物和生成物的类别以及反应前后物质种类的多少,把化学反应分为化合反应、分解反应、置换反应和复分解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
欲用98%的浓硫酸(p=1.84g·cm-3 )配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1) 选用的主要仪器有:
①__________,②__________,③__________,④____________,⑤____________。
(2) 请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4 B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线 D.洗净所用仪器
E.稀释浓H2SO4 F.将溶液转入容量瓶
其操作正确的顺序依次为__________ __________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
(4)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有Mn2+的酸性溶液中滴加过二硫酸钾(K2S2O8)溶液,会发生如下反应(未配平):Mn2++S2O +H2O―→MnO
+H2O―→MnO +SO
+SO +H+。下列说法正确的是( )
+H+。下列说法正确的是( )
A.该反应中起氧化作用的是Mn2+
B.反应中有1 mol还原剂参加反应时,转移的电子物质的量为4 mol
C.反应后溶液的pH降低
D.该反应常用于检验溶液中Mn2+的存在,现象是溶液紫红色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,正确的是( )
A.向NaOH溶液中加入少量Mg(HCO3)2溶液:2OH-+Mg2+===M g(OH)2↓
g(OH)2↓
B.向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液:HCO +Ba2++H++SO
+Ba2++H++SO ===BaSO4↓+H2O+CO2↑
===BaSO4↓+H2O+CO2↑
C.酸性KMnO4溶液与H2O2反应:2MnO +10H++3H
+10H++3H 2O2===2Mn2++3O2↑+8H2O
2O2===2Mn2++3O2↑+8H2O
D.向Fe(NO3)3溶液中加入过量HI溶液:Fe3++3NO +12H++10I-===Fe2++3NO↑+5I2+6H2O
+12H++10I-===Fe2++3NO↑+5I2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H22NH3实现储氢和输氢。下列说法正确的是________。
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH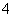 与PH
与PH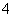 、CH4
、CH4 、BH
、BH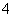 、ClO
、ClO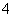 互为等电子体
互为等电子体
c.相同压强下,NH3沸点比PH3的沸点 高
高
d.[Cu(NH3)4]2+中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是________________________________________。
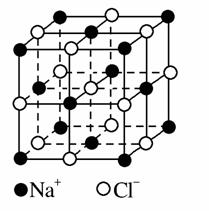
Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代 表物,其晶胞结构如图所示。
表物,其晶胞结构如图所示。
(1)设氯化钠晶体中Na+与跟它最近邻的Cl-之间的距离为r,则与Na+次近邻的Cl-个数为________,该Na+与跟它次近邻的Cl-之间的距离为________。
(2)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为________。(用含a、b的式子
表示)
(3)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为___ _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com