
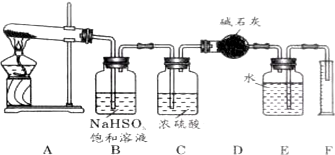
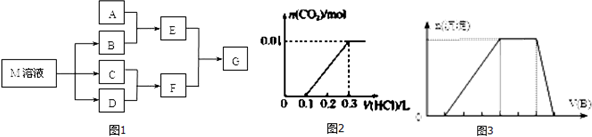
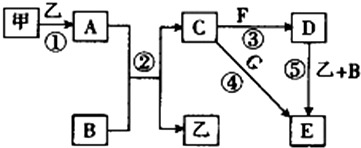
分析 (1)根据混合气体中有三氧化硫,NaHSO3能与三氧化硫反应生成Na2SO4、H2O和SO2;
(2)根据浓硫酸可作干燥剂;根据SO2能与碱石灰反应,而氧气与与碱石灰不反应;
(3)根据氧气不溶于水,可用排水法测定气体的体积;
(4)根据量筒内液体的体积即为O2的体积,根据n=$\frac{v}{vm}$来分析;根据干燥管增重的质量为SO2的质量(包括原来的和通NaHSO3后生成的),再根据电子得失守恒n(O2)×4=n(SO2)×2求出分解产生的SO2的物质的量,最后根据方程式SO3+2NaHSO3=Na2SO4+H2O+2SO2↑求出SO3的物质的量.
解答 解:(1)混合气体中有三氧化硫,NaHSO3能与三氧化硫反应生成Na2SO4、H2O和SO2:SO3+2NaHSO3=Na2SO4+H2O+2SO2↑,可NaHSO3来除去三氧化硫,
故答案为:吸收生成的SO3气体;SO3+2NaHSO3=Na2SO4+H2O+2SO2↑;
(2)浓硫酸可作干燥剂,可吸收SO2和O2中的水蒸气;SO2能与碱石灰反应,而氧气与与碱石灰不反应,所以干燥管收集到的物质是SO2,
故答案为:干燥SO2和O2;SO2;
(3)因氧气不溶于水,可用排水法测定气体的体积,将由D来的气体将E中的水压到量筒F中,测定生成O2的体积,
故答案为:由D来的气体将E中的水压到量筒F中,测定生成O2的体积;
(4)量筒内液体的体积即为O2的体积,其物质的量为$\frac{0.112L}{22.4L/mol}$=0.005mol,根据电子得失守恒n(O2)×4=n(SO2)×2,即0.005mol×4=n(SO2)×2,则n(SO2)=0.01mol,干燥管增重的质量为SO2的质量(包括原来的和通NaHSO3后生成的)为1.28g,物质的量为0.02mol,所以与NaHSO3反应生成的SO2为0.01mol,由方程式SO3+2NaHSO3=Na2SO4+H2O+2SO2↑可知SO3的物质的量为0.005mol,
故答案为:O2;0.005;0.01;0.005.
点评 本题主要考查了实验的原理与计算,在计算时要抓住电子得失守恒,尤其要注意干燥管增重的质量为SO2的质量包括原来的和通NaHSO3后生成的,题目难度中等.


科目:高中化学 来源: 题型:实验题

| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
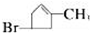 .化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.
.化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.
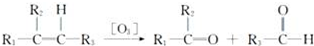
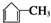 ,G2所含官能团为醛基、羰基.
,G2所含官能团为醛基、羰基.
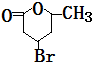 +H2O.
+H2O.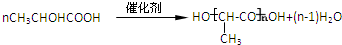 .
.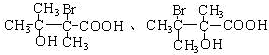 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,Na+、H+、Cl-、SCN-可以大量共存 | |
| B. | 通入H2S气体至过量会生成两种沉淀 | |
| C. | 加入NaOH溶液至Fe3+刚好沉淀完全的离子方程式:NH4++Fe3++4OH-═Fe(OH)3↓+NH3•H2O | |
| D. | 离子浓度关系:c(SO42-)>c(NH4+)>c(Fe3+ )>c(H+ )>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向Fe(NO3)3溶液中通入SO2,滴加BaCl2溶液; 产生白色沉淀 | NO3-在酸性条件下能氧化SO2生成SO42- |
| B | 向Fe(NO3)2溶液中滴加少量盐酸; 浅绿色变深绿色 | 溶液中存在Fe2+水解平衡移动 |
| C | 向沸水中滴加FeCl3饱和溶液,煮沸得红褐色液体;用激光灯照射液体,有一条明亮“通路” | 该液体分散质直径介于1nm与100nm之间 |
| D | 向FeI2溶液中滴加酸化的双氧水和淀粉溶液;溶液为蓝色 | Fe2+的还原性比I-的还原性弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两原子N层上都有1个s电子,一个原子有d电子,另一个原子无d电子 | |
| B. | 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 | |
| C. | 原子核外M层上的s、p轨道都充满电子,而d轨道上没有电子的两种原子 | |
| D. | 两原子的核外全部都是s电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
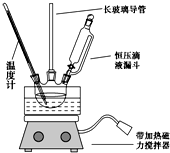 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂.
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可作有机溶剂. HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$
HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50~60℃}$ +H2O
+H2O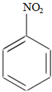 +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{95℃}$ +
+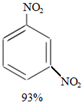 +
+
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃) | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸[来] | - | 83 | 1.4 | 易溶于水 |
| 浓硫酸 | - | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com