
| A. | 达到平衡时X浓度为0.04 mol•L-1 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为0.015 mol•L-1 | |
| C. | 若升高温度,X的体积分数增大,则该反应的?△H<0 | |
| D. | 若增大压强,平衡向正反应方向移动,平衡常数变大 |
分析 经60s达到平衡,正反应速率等于逆反应速率,达到平衡之后,如外界条件不变,则平衡状态不变,正逆反应速率相等,结合生成Z的物质的量进行相关的计算.
解答 解:A、生成0.3molZ,说明有0.6molX反应,剩余X0.4mol,容器体积为10L,所以平衡时X浓度为0.04 mol•L-1,故A正确;
B、容器体积变为20 L,平衡逆向移动,Z的物质的量减少,故B错误;
C、升温平衡向吸热分析移动,X体积分数增大,说明逆反应吸热,则正反应放热,故C正确;
D、化学平衡常数只受温度影响,温度不变,K不变,故D错误;
故选AC.
点评 本题考查了影响化学平衡移动和影响化学平衡常数的因素,主要化学平衡常数只受温度影响,题目难度不大.


科目:高中化学 来源: 题型:解答题
 某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体H2、CO2(答2种即可);若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体H2,写出反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体H2、CO2(答2种即可);若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体H2,写出反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| 实验编号 | T/℃ | NO初始浓度mol•L-1 | CO初始浓度mol•L-1 | 催化剂的比表面积m2•g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
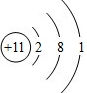 ;A、B两元素形成化合物的名称是氯化钠,用电子式表示该化合物的形成过程
;A、B两元素形成化合物的名称是氯化钠,用电子式表示该化合物的形成过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40% | B. | 60% | C. | 30% | D. | 50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤干馏可以得到甲烷、苯和氨等重要化工原料 | |
| B. | 乙烯、乙醇和乙酸均能发生加成反应 | |
| C. | 苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环结构 | |
| D. | 向鸡蛋清溶液中分别加入(NH4)2SO4和CuSO4溶液都能使鸡蛋清聚沉,其作用原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com