
| A. | 1 mol CH3CH2CH2CH3分子储存的能量大于1 mol (CH3)2CHCH3分子 | |
| B. | 1 mol CH3CH2CH2CH3分子储存的能量小于1 mol (CH3)2CHCH3分子 | |
| C. | (CH3)2CHCH3转化为CH3CH2CH2CH3的过程是一个放热过程 | |
| D. | 断开1 mol物质中化学键吸收的能量CH3CH2CH2CH3大于(CH3)2CHCH3 |
分析 A、根据化学反应中能量守恒,放出的热量=反应物的总能量-生成物的总能量;
B、根据化学反应中能量守恒,放出的热量=反应物的总能量-生成物的总能量;
C、根据(CH3)2CHCH3转化为CH3CH2CH2CH3的能量高低来判断;
D、在不同的物质中,断开相同的化学键吸收的热量相等.
解答 解:A、1mol CH3CH2CH2CH3完全燃烧放出 2878 kJ热量,1mol(CH3)2CHCH3燃烧放出2869 kJ热量,故1mol CH3CH2CH2CH3具有的能量大于1mol(CH3)2CHCH3具有的能量,故A正确,
B、1mol CH3CH2CH2CH3完全燃烧放出 2878 kJ热量,1mol(CH3)2CHCH3燃烧放出2869 kJ热量,故1mol CH3CH2CH2CH3具有的能量大于1mol(CH3)2CHCH3具有的能量,故B错误;
C、(CH3)2CHCH3转化为CH3CH2CH2CH3是能量小的转化成能量大的,故要吸热,则(CH3)2CHCH3的总键能大于CH3CH2CH2CH3的总键能,故断开1 mol物质中化学键吸收的能量CH3CH2CH2CH3小于(CH3)2CHCH3,故C错误,
D、(CH3)2CHCH3转化为CH3CH2CH2CH3是能量小的转化成能量大的,故要吸热,则(CH3)2CHCH3的总键能大于CH3CH2CH2CH3的总键能,故断开1 mol物质中化学键吸收的能量CH3CH2CH2CH3小于(CH3)2CHCH3,故D错误.
故选A.
点评 本题主要考查了化学反应中能量守恒,难度不大,注意知识的归纳和梳理是关键.


科目:高中化学 来源: 题型:选择题
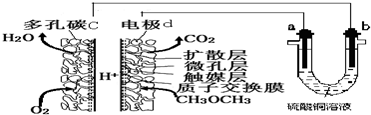
| A. | 多孔碳c能增大气固接触面积,提高反应速率,该电极为负极 | |
| B. | 燃料电池工作时,电极d上发生的反应为:CH3OCH3+12e-+3H2O═2CO2+12H+ | |
| C. | 二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇CH3OH)直接燃料电池能量密度的1.4倍 | |
| D. | a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20倍 | B. | 100倍 | C. | 200倍 | D. | 500倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
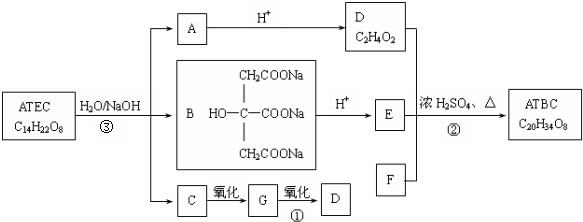
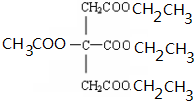 +NaOH$\stackrel{△}{→}$CH3COONa+
+NaOH$\stackrel{△}{→}$CH3COONa+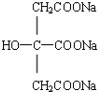 +3CH3CH2OH+3H2O.
+3CH3CH2OH+3H2O.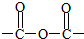 ,E分子在浓硫酸、加热条件下可生成分子甲,其分子式为C6H6O6,则符合上述条件甲分子有2种.
,E分子在浓硫酸、加热条件下可生成分子甲,其分子式为C6H6O6,则符合上述条件甲分子有2种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol/L | B. | 0.4 mol/L | C. | 0.5 mol/L | D. | 0.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含金属元素的离子不一定是阳离子 | |
| B. | 一种元素可形成多种离子,但只能是带同种电荷的离子 | |
| C. | 由同种元素组成的物质肯定属于纯净物 | |
| D. | 具有相同质子数的粒子都属于同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAl(SO4)2溶液中滴加Ba(OH)2直至SO42-沉淀完全:2Al3++6OH-+3SO42-+3Ba2+=2Al(OH)3↓+3BaSO4↓ | |
| B. | NH4HS溶液与少量的NaOH溶液反应:NH4++OH-=NH3•H2O | |
| C. | 稀H2SO4和Na2S2O3溶液共热:S2O32-+2H+$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+S↓+H2O | |
| D. | 过量Cl2通入Fel2溶液中:3Cl2+2I-+4Fe2+=4Cl-+I2+4Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com