
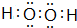 .
.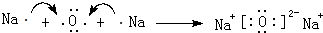 .
. 分析 A、B、C、D是短周期中原子序数依次增大的四种元素,A在周期表中原子半径最小,则A为H元素;B是地壳中含量最高的元素,则B为O元素;B、D位于同一主族,则D为S元素;C的原子序数大于氧,C的原子半径在同周期中最大,则C为Na.
解答 解:A、B、C、D是短周期中原子序数依次增大的四种元素,A在周期表中原子半径最小,则A为H元素;B是地壳中含量最高的元素,则B为O元素;B、D位于同一主族,则D为S元素;C的原子序数大于氧,C的原子半径在同周期中最大,则C为Na.
(1)由上述元素形成的具有漂白作用的物质有:SO2、H2O2、Na2O2、O3等,
故答案为:SO2、H2O2、Na2O2;
(2)含B元素质量分数最高的化合物为H2O2,电子式: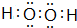 ,故答案为:
,故答案为: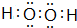 ;
;
(3)分别由A、B、C、D四种元素组成的两种化合物X和Y可以发生反应,应是亚硫酸氢钠与硫酸氢钠反应生成二氧化硫与水,该反应的离子方程式:HSO3-+H+═H2O+SO2↑,故答案为:HSO3-+H+═H2O+SO2↑;
(4)用电子式表示Na2O的形成过程: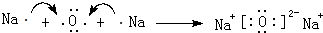 ,
,
故答案为: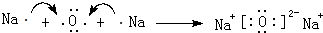 .
.
点评 本题考查位置结构性质关系,推断元素是解题关键,侧重对化学用语与元素化合物性质的考查,掌握用电子式表示化学键或物质的形成.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{n}$ mol-1 | B. | 9n mol-1 | C. | 2nmol-1 | D. | 18nmol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 g C2H6中含有的化学键数目为8NA | |
| B. | 1 L0.1mol•L-1醋酸溶液中含有的H+数为0.1 NA | |
| C. | 78 g Na2O2;和Na2S的混合物中含有的阴离子数目为NA | |
| D. | 2.24 L CI2与足量铁粉在一定条件下充分反应,转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H<0,反应物总能量>生成物总能量 | |
| B. | 相同条件下1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
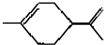 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 常温下为气态,难溶于水 | |
| C. | 分子式为C10H18 | |
| D. | 与过量的溴的CCl4溶液反应后产物为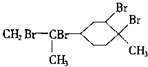 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 二 | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑦ | ⑥ | ||
| 四 | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com