
已知25 ℃时,下列酸的电离常数:醋酸:1.75×10-5氢氰酸:4.93×10-10
氢氟酸:7.2×10-4甲酸:1.77×10-4则物质的量浓度均为0.1 mol·L-1的上述溶液酸性最强的是 ( )
A 醋酸 B 氢氰酸 C氢氟酸 D甲酸
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:阅读理解
| 10-7b |
| a-b |
| 10-7b |
| a-b |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
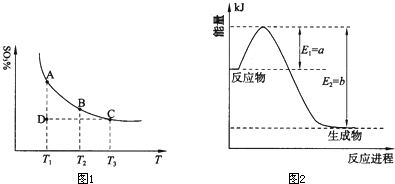
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g)2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g)2SO3(g)的△H 0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状态D时,
(填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,
请写出工业合成氨的热化学反应方程式: 。
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水。在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江瑞安中学高二下学期期中考试化学试卷(带解析) 题型:填空题
(1)某温度(t℃)时,测得0.01 mol·L-1的NaOH溶液的pH=13,请回答下列问题:
①该温度下水的Kw=
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H=―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_________________
(3)已知25°C时Ksp(Mg(OH)2)=1.8×10-11,为除去某食盐溶液中的Mg2+,可用NaOH为除杂试剂,当控制溶液pH=12时,可确保Mg2+ 除尽,此时溶液中Mg2+的物质的量浓度为
mol·L-1
查看答案和解析>>
科目:高中化学 来源:2011届山东省莱芜一中高三上学期期末复习(二)(理综)化学部分 题型:填空题
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)
2SO2(g) +O2(g)
+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
2SO3(g)的△H 0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状态D时,
 (填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,
请写出工业合成氨的热化学反应方程式: 。
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水。在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白 色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时 )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com