
| A、X、Y都是金属时,则X一定比Y活泼 |
| B、X一定排在金属活动顺序表中H的前面 |
| C、X是金属时,Y可能是金属也可能是非金属 |
| D、X是非金属时,Y可能是金属也可能是非金属 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、
| ||
| B、使pH试纸显红色的溶液:K+、I-、Cl-、NO3- | ||
| C、由水电离的c(H+)=1×10-14mol?L-1的溶液:Na+、K+、AlO2-、Cl- | ||
| D、澄清透明的无色溶液:Na+、Cu2+、Cr2O72-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、依靠氯气分子本身的较强氧化性杀菌 |
| B、生成盐酸,使病菌无法存活 |
| C、依靠氯原子的还原性起杀菌消毒的作用 |
| D、依靠次氯酸的强氧化性起杀菌消毒的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子晶体干冰有很高的熔点、沸点,有很大的硬度 |
| B、原子晶体干冰易汽化,可用作制冷材料 |
| C、原子晶体干冰硬度大,可用作耐磨材料 |
| D、每摩尔原子晶体干冰中含2 mol C-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应前后,元素是否有电子转移 |
| B、反应前后,元素是否有化合价变化 |
| C、反应前后,是否有氧元素参加 |
| D、反应前后,是否有氢元素参加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同系物不可能是同分异构体 |
| B、CH3Cl和CHCl3互为同系物 |
| C、同分异构体不能互称为同系物 |
| D、C4H10分子中四个碳原子在一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该碳氢化合物为2-甲基-1,3-戊二烯 |
| B、该碳氢化合物与溴单质1:1加成时可以生成3种不同的产物 |
| C、该碳氢化合物与溴单质1:1加成时可以生成2种不同的产物 |
| D、该碳氢化合物与足量氢气加成时可以生成正戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
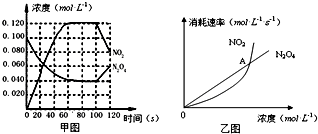
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的PH值 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com