
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B△H=+119kJ•mol-1,可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 在25°C、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ量,则表示H2燃烧热的化学方程式 2H2(g)+O2(g)═2H2O(l)△H=-571kJ•mol-1 |
分析 A、硫蒸气变化为硫固体为放热过程;
B、依据反应热量变化判断物质能量大小,物质能量越高越不稳定;
C、中和热是强酸强碱的稀溶液反应生成1mol水时放出的热量;
D、H2燃烧热是1mol氢气完全燃烧生成稳定氧化物放出的热量.
解答 解:A、硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,故A错误;
B、由单质A转化为单质B,△H=+119kJ/mol,反应吸热,B的能量高于A,可知A比B稳定,故B错误;
C、中和热是强酸强碱的稀溶液反应生成1mol水时放出的热量,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,故C正确;
D、在101kPa时,2gH2完全燃烧,生成液态水,放出285.8KJ热量,则氢气燃烧的热化学方程式表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8KJ/mol,故D错误;
故选C.
点评 本题考查了反应热量变化,热化学方程式的正误判断,物质能量与稳定性的比较方法,题目难度中等.


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:选择题
| A. | 沸点高低:HI>HBr>HCl>HF | |
| B. | 热稳定性大小:HF>H2O>NH3>PH3 | |
| C. | 熔点高低:金刚石>食盐>金属钠>冰 | |
| D. | 微粒半径大小:S2->Cl->F->Na+>Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物不一定都不溶于水 | |
| B. | 有机物都是共价化合物 | |
| C. | 有机物都是从有机体中分离出来的物质 | |
| D. | 有机物不具备无机物的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鱼虾会产生不愉快的腥臭味,可在烹调时加入少量食醋和料酒 | |
| B. | “酸可以除锈”,“汽油可以去油污”都是发生了化学变化 | |
| C. | 被蜂蚁蜇咬会感觉疼痛难忍,这是由于人的皮肤被注入了甲酸的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 苯酚溶液可用于环境消毒,医用酒精可用于皮肤消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1mol/L | C. | 1.25mol/L | D. | 2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
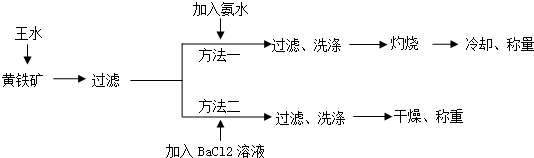
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能 | I1 | I2 | I3 | I4 | … |
| Ia/kJ•mol-1 | 578 | 1 817 | 2 745 | 11 578 | … |
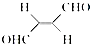 ,下列叙述正确的有AD.
,下列叙述正确的有AD.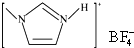 的熔点(填“>”、“=”或“<”),其原因是
的熔点(填“>”、“=”或“<”),其原因是查看答案和解析>>
科目:高中化学 来源: 题型:解答题
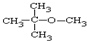 .
.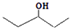 ,乙所含官能团的名称为羟基.
,乙所含官能团的名称为羟基.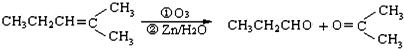
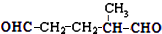 ,则烃A的结构可表示为
,则烃A的结构可表示为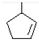 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com