
【题目】某溶液遇石蕊试液显红色,下列各组离子中能在该溶液中大量共存的是
A.H+、NO3-、Ca2+、Cl-
B.Cu2+、SO42-、HCO3-、Na+
C.Fe2+、NO3-、OH-、Ba2+
D.MnO4-、SO42-、NO3-、CO32-
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各组中的离了,能在溶液中大量共存的是( )
A. SO42-、Na+、Cl-、Ba2+ B. H+、Fe2+、NO3-、OH-
C. H+、K+、CO32-、HCO3- D. Na+、Cu2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法中错误的是( )
物质 | 杂质 | 除杂质的方法 | |
A | CaCl2溶液 | HCl | 过量CaCO3、过滤 |
B | NaOH溶液 | Ca(OH)2 | 过量Na2CO3溶液、过滤 |
C | FeCl2溶液 | CuCl2 | 过量铁粉、过滤 |
D | CO2 | H2O | 通过盛浓硫酸的洗气瓶 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届天水市一中期末】钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业利用碘、NaOH和铁屑为原料可生产碘化钠,其生产流程如图所示:
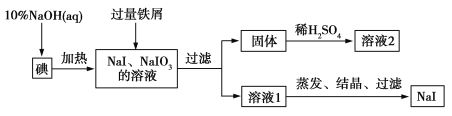
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO![]() 与IO-的物质的量之比为1∶1,则该反应的离子方程式为______ 。
与IO-的物质的量之比为1∶1,则该反应的离子方程式为______ 。
(2)生产流程中加入过量铁屑的目的是__________________,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是________ __________。
(3)溶液2中除含有H+外,一定含有的阳离子是______ ____________;试设计实验证实该金属阳离子的存在:__________________________________。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60 g草酸亚铁晶体(相对分子质量是180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:
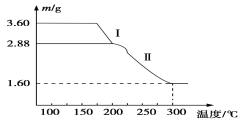
①分析图中数据,根据信息写出过程I发生的化学方程式:____________ ______。
②300℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式:________ ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A. 澄清石灰水与稀盐酸反应Ca(OH)2+2H+===Ca2++2H2O
B. 氢氧化钡与硫酸反应OH-+H+===H2O
C. 铜片插入硝酸银溶液中Cu+Ag+===Cu2++Ag
D. 氯化镁溶液与氢氧化钠溶液反应Mg2++2OH-===Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届哈师大附中期中】如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是 ( )

A.过氧化钠 B.氧化钠
C.钠 D.钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若要证明某溶液中不含Fe3+而可能含Fe2+ , 乙同学进行如下实验操作时,最佳顺序是:①加足量氯水②加足量KMnO4溶液③加少量KSCN溶液( )
A.①②
B.③②
C.③①
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种钠的化合物,其中A为淡黄色粉末,B、C、D为白色固体,它们相互之间有下列关系。

试回答下列问题:
⑴试写出A、B、C、D的化学式:A:_______、D:_______、E:________。
⑵写出反应②的离子方程式:__________________。
⑶写出B与C溶液反应的离子方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2 L的密闭容器内为加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化的情况如图所示:
2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化的情况如图所示:
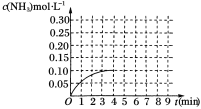
(1)根据上图,计算从反应开始到平衡时,平均反应速率υ(NH3)=___________ mol·L-1·min-1。
(2)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________(填字母序号)。
A.0.20 mol·L-1 B.0.12 mol·L-1
C.0.10 mol·L-1 D.0.08 mol·L-1
(3)该反应平衡常数K=____________。
(4)反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,平衡________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数____________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(设此时NH3的浓度为0.25 mol·L-1)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com