
分析 由FeO(s)+CO(g)?Fe(s)+CO2(g)可知,K=$\frac{c(C{O}_{2})}{c(CO)}$=0.25,以此计算达到平衡时n(CO):n(CO2);
在1L密闭容器中加入0.02mol FeO(s),并通入xmolCO,t℃时反应达到平衡.此时FeO(s)转化率为50%,转化的FeO为0.01mol,则
FeO(s)+CO(g)?Fe(s)+CO2(g)
开始0.02 x 0 0
转化0.01 0.01 0.01 0.01
平衡0.01 x-0.01 0.01 0.01
K=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{0.01}{x-0.01}$=0.25,以此计算.
解答 解:由FeO(s)+CO(g)?Fe(s)+CO2(g)可知K=$\frac{c(C{O}_{2})}{c(CO)}$=0.25,则达到平衡时n(CO):n(CO2)=4:1;
在1L密闭容器中加入0.02mol FeO(s),并通入xmolCO,t℃时反应达到平衡.此时FeO(s)转化率为50%,转化的FeO为0.01mol,则
FeO(s)+CO(g)?Fe(s)+CO2(g)
开始0.02 x 0 0
转化0.01 0.01 0.01 0.01
平衡0.01 x-0.01 0.01 0.01
K=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{0.01}{x-0.01}$=0.25,解得x=0.0125mol,
故答案为:4:1;0.0125mol.
点评 本题考查化学平衡常数的计算,为高频考点,把握平衡常数的含义、化学平衡三段法为解答的关键,侧重分析与计算能力的考查,注意纯固体不能代入K的表达式中,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
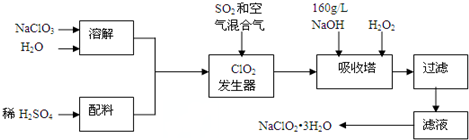
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔点、沸点 | |
| B. | 乙醛、乙酸和葡萄糖都能与新制的Cu(OH)2反应,且反应类型均为氧化反应 | |
| C. | 乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K1=K2 | B. | K1<K2 | C. | K1>K2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:
某实验小组用0.50mol/L NaOH溶液和0.50mol/L H2SO4溶液进行中和热的测定:| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
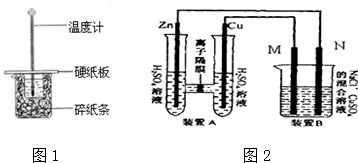
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
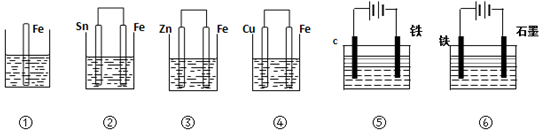
| A. | ④>②>①>③>⑤>⑥ | B. | ⑥>④>②>①>③>⑤ | C. | ④>②>⑤>③>⑥>① | D. | ⑥>③>②>④>①>⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com