
| A. | 分子中键角小于109.5°是因为氮原子轨道杂化类型为sp2杂化 | |
| B. | Cl的电负性强于N的电负性 | |
| C. | NCl3分子是极性分子 | |
| D. | NBr3 比NCl3易挥发 |
分析 A、根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,据此判断杂质类型;
B、非金属性越强电负性越大,金属性越强电负性越小
C、根据NC13的分子空间构型与氨分子相似;
D、分子晶体中物质的熔沸点与相对分子质量有关,相对分子质量越大,其熔沸点越高,物质的熔沸点越低越容易挥发.
解答 解:A、NCl3中N形成3个δ键,孤电子对数=$\frac{5-3×1}{2}$=1,为sp3杂化,故A错误;
B、氯的非金属性强于氮,所以Cl的电负性强于N的电负性,故B正确;
C、NC13的分子空间构型与氨分子相似,都是三角锥型结构,氨分子是极性分子,所以NCl3分子也是极性分子,故C正确;
D、分子晶体,相对分子质量越大,其熔沸点越高,所以NBr3比NCl3的熔沸点高,NCl3比NBr3易挥发,故D错误.
故选BC.
点评 本题以信息的形式考查NCl3分子空间结构、分子极性、熔沸点等知识,明确信息并结合所学知识即可解答,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应达到平衡时,降低温度,平衡逆向移动 | |
| B. | 使用催化剂,正反应速率增大,逆反应速率减小 | |
| C. | 加压,平衡不移动,但正、逆反应速率都不改变 | |
| D. | 减小SO2的浓度,平衡逆向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
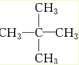 ,名称为2,2-二甲基丙烷(新戊烷).
,名称为2,2-二甲基丙烷(新戊烷).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHS溶液中:SO42-、K+、Cl-、Cu2+ | |
| B. | 在c(H+)/C(OH-)=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| C. | 加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- | |
| D. | 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com