
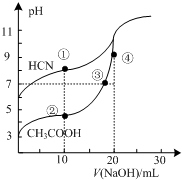
 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①和点②所示溶液中:c(CH3COO-)<c(CN-) | |
| B. | 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) | |
| D. | 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
分析 A.根据点①和点②所示溶液中的电荷守恒分析;
B.点③中pH=7,则c(OH-)=c(H+);
C.根据点①和点②所示溶液中的物料守恒分析;
D.点②和点③所示溶液中存在电荷守恒.
解答 解:A.点①的溶液中存在电荷守恒为c(OH-)+c(CN-)=c(Na+)+c(H+),而且c(OH-)>c(H+),点②所示溶液中的电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+),而且c(OH-)<c(H+),二者中钠离子浓度相同,所以c(CH3COO-)>c(CN-),故A错误;
B.点③中pH=7,则c(OH-)=c(H+),则点③中c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故B错误;
C.点①的溶液中存在物料守恒为c(HCN)+c(CN-)=c(Na+),点②所示溶液中的物料守恒为c(CH3COOH)+c(CH3COO-)=c(Na+),二者中钠离子浓度相同,则c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),故C正确;
D.点②和点③所示溶液中存在电荷守恒c(OH-)+c(CH3COO-)=c(Na+)+c(H+),在③中Na元素的物质的量与醋酸的总物质的量相同,由于醋酸根离子要水解,所以c(Na+)>c(CH3COOH),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故D错误.
故选C.
点评 本题考查酸碱混合溶液中离子浓度的关系,明确混合后溶液中的溶质是解答的关键,注意电荷守恒和物料守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4溶液中:c(H+)═c(SO42-)+c(HSO4-)+c(OH-) | |
| B. | 氨水中:c(NH4+)═c(OH-)>c(H+) | |
| C. | a mol•L-1的醋酸与0.01 mol•L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的Ka=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 0.1 mol•L-1的盐酸与0.2 mol•L-1氨水等体积混合后,溶液中:c(OH-)+c(Cl-)═c(H+)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 10种 | C. | 12种 | D. | 15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打是发酵粉的主要成分 | |
| B. | 铁表面镀锌可增强其抗腐蚀性 | |
| C. | 向汽油中添加乙醇后,该混合燃料的热值不变 | |
| D. | 粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 表1.几种砷酸盐的Ksp | |
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-9 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 7.2×10-21 |
| 表2.工厂污染物排放浓度及允许排放标准 | ||
| 污染物 | H2SO4 | As |
| 浓度 | 19.6g/L | 1.6g•L-1 |
| 排放标准 | pH6~9 | 0.5mg•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+=3Fe2+ | |
| B. | 当加入16.8 g铁粉时,可生成标准状况下6.72 L气体 | |
| C. | 在铁粉充分反应后的溶液中,铁元素以Fe2+和Fe3+的形式存在 | |
| D. | m至少等于28 g,反应过程中溶液的质量一直在减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
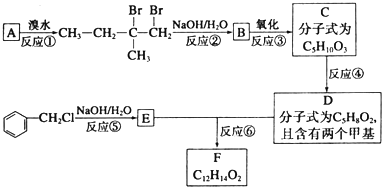
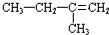 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯能使溴水褪色,发生取代反应 | |
| B. | 乙烯使高锰酸钾溶液褪色,发生加成反应 | |
| C. | 乙醇在红热铜丝的作用下,能发生氧化反应 | |
| D. | 葡萄糖在稀硫酸作催化剂,水浴加热条件下可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
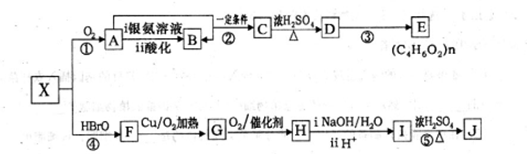

 .
. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com