
| A. | 16g CH4含有4NA个电子 | |
| B. | 0.1mol铁和0.1mol铜分别与0.1mol氯气完全反应,转移的电子数均为0.2NA | |
| C. | 标准状况下,11.2L H2O中分子数为0.5NA个 | |
| D. | 0.1mol•L-1 Na2CO3溶液中含有0.2NA个Na+ |
分析 A、求出甲烷的物质的量,然后根据1mol甲烷含10mol电子来分析;
B、0.1mol铁与0.1mol氯气反应水,铁过量;0.1mol铜和0.1mol氯气恰好完全反应;
C、标况下水为液态;
D、溶液体积不明确.
解答 解:A、16g甲烷的物质的量为1mol,而1mol甲烷含10mol电子,即10NA个,故A错误;
B、0.1mol铁与0.1mol氯气反应水,铁过量,0.1mol氯气完全反应,故转移0.2mol电子;0.1mol铜和0.1mol氯气恰好完全反应,也转移0.2mol电子即0.2NA个,故B正确;
C、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、溶液体积不明确,故溶液中钠离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题

| A. | M:Na X:O2 | B. | M:HNO3 X:Fe | C. | M:NH3 X:O2 | D. | M:Al X:NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰用作食品抗氧化剂 | |
| B. | Cl2+2Br-═2Cl-+Br2、Zn+Cu2+═Zn2++Cu均为单质被还原的置换反应 | |
| C. | 将KI和FeCl3溶液在试管中混合后,加入CCl4振荡、静置,下层溶液显紫红色,氧化性:Fe3+>I2 | |
| D. | 用含硅胶,铁粉的透气小袋与食品一起密封包装,这个过程不涉及化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
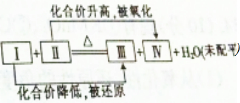 一个化学反应体系中含有浓H2SO4,Cu,H2O,CuSO4,SO2 5种物质,其发生反应的化学方程式可用如图表示,则Ⅳ处的物质是( )
一个化学反应体系中含有浓H2SO4,Cu,H2O,CuSO4,SO2 5种物质,其发生反应的化学方程式可用如图表示,则Ⅳ处的物质是( )| A. | H2SO4 | B. | CuSO4 | C. | Cu | D. | SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 选用酒精作为萃取剂从碘水中萃取碘 | |
| B. | 蒸发操作时,待蒸发皿中的水分完全蒸干后再停止加热 | |
| C. | 在做蒸馏实验时,冷凝器中的水流方向应该与馏分的流动方向相反 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| E. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶中液面下,但不能接触瓶底 | |
| F. | 分液漏斗使用前不需检查是否漏水,但需要用蒸馏水洗涤2-3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料.其常用的制备方法有两种:
羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料.其常用的制备方法有两种:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com