
 �������������������ܽ�Ȳ�ͬ����˿���������һ���ʣ�������Һ��pH���ﵽ����������ӵ�Ŀ�ģ����ܽ��������������ڲ�ͬpH�µ��ܽ�ȣ�s��mol?L-1����ͼ��
�������������������ܽ�Ȳ�ͬ����˿���������һ���ʣ�������Һ��pH���ﵽ����������ӵ�Ŀ�ģ����ܽ��������������ڲ�ͬpH�µ��ܽ�ȣ�s��mol?L-1����ͼ��| ���� | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3��10-18 | 2.5��10-13 | 1.3��10-36 | 3.4��10-28 | 6.4��10-53 | 1.6��10-24 |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
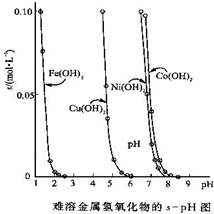 �������������������ܽ�Ȳ�ͬ����˿���������һ���ʣ�������Һ��pH���ﵽ����������ӵ�Ŀ�ģ����ܽ��������������ڲ�ͬpH�µ��ܽ�ȣ�s��mol?L-1����ͼ��
�������������������ܽ�Ȳ�ͬ����˿���������һ���ʣ�������Һ��pH���ﵽ����������ӵ�Ŀ�ģ����ܽ��������������ڲ�ͬpH�µ��ܽ�ȣ�s��mol?L-1����ͼ��| ���� | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3��10-18 | 2.5��10-13 | 1.3��10-36 | 3.4��10-28 | 6.4��10-53 | 1.6��10-24 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| [CO] | [CO2] |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010���Ĵ������߿�Ԥ�⣨�ۺ��⣩��ѧ�� ���ͣ������
��16�֣��������ʼ��仯�����빤ũҵ�������ճ����������е���ϵ����ش��������⣺
��2��һ���¶��£�������������һ����̼�������·�Ӧ��
�ٸ��¶�ʱ����2 Lʢ��Fe2O3��ĩ���ܱ�������ͨ��CO���壬5 min�������˵�����11.2 g�������ʱ����CO�ķ�Ӧ����Ϊ ��
�ڴ�ƽ������¶����ߣ���ֵ������Q 0���>������=������<������
��3����ҵ�����ݽ������������������ܽ�Ȳ�ͬ��ͨ��������Һ��pH���ﵽ����������ӵ�Ŀ�ġ��������ܽ��������������ڲ�ͬpH�µ��ܽ������s/mol��L-1������Ҫ��ȥCuCl2��Һ������Fe3+��Ӧ������Һ��pHΪ ������ţ��� 
A����l B��4���� C������6 D������9
��4��ij��ҵ��ˮ�к���Cu2+��Pb2+��Hg2+������ҵ��ˮ�м��������FeS����FeS��CuS��PbS��HgS����ʱ����Һ��c��Fe2+����c��Pb2+����c��Hg2+��= �� �� ��
��֪��Ksp��FeS��=6.3��10-18mol2��L-2��Ksp��PbS��=3.4��10-28mol2��L-2
Ksp��CuS��=1.3��10-36mol2��L-2��Ksp��HgS��=6.4��10-53mol2��L-2
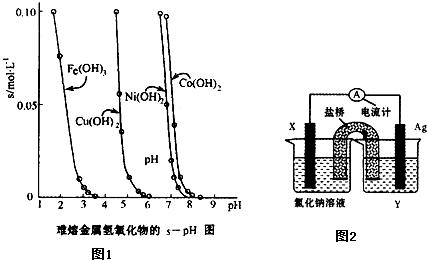
��5������������ԭ��Ӧ��Cu2+��aq��+Fe��s��===Fe2+��aq��+Cu��s����Ƴ���ͼ��ʾ��ԭ��أ�����ڸõ��װ�õ�˵���в���ȷ���� ������ţ���
A���缫X�IJ�����Fe
B���������ҺY��AgNO3��Һ
C��ԭ��ع���ʱ�������е������Ӳ���������ص��Ȼ�����Һ��
D��ԭ��ع���ʱ��x�缫��ӦΪ��O2+2H2O+4e-��4OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ��ɽ��ʡ������ѧ����ĩ��⻯ѧ�Ծ� ���ͣ������
(10��)�������������������ܽ�Ȳ�ͬ����˿���������һ���ʣ�������Һ��pH���ﵽ����������ӵ�Ŀ�ġ����ܽ��������������ڲ�ͬpH�µ��ܽ��(s��mol��L��1)����ͼ��

(1)pH��3ʱ��Һ��ͭԪ�ص���Ҫ������ʽ�ǣ�________(��ѧʽ)
(2)��Ҫ��ȥCuCl2��Һ�е�����Fe3����Ӧ�ÿ�����Һ��pHΪ
A����1 B��4���� C����6
(3)��Ni(NO3)2��Һ�к���������Co2�����ʣ�___ (�ܡ�����)ͨ��������ҺpH�ķ�������ȥ��������_________��
(4)��֪һЩ��������ܶȻ��������±���
|
���� |
FeS |
MnS |
CuS |
PbS |
HgS |
ZnS |
|
Ksp |
6.3��10��18 |
2.5��10��13 |
1.3��10��36 |
3.4��10��28 |
6.4��10��53 |
1.6��10��24 |
ij��ҵ��ˮ�к���Cu2����Pb2����Hg2������������˹�ҵ��ˮ�м��������_______��ȥ���ǡ�
A��NaOH B��FeS C��Na2S
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com