

| A、把SO2通入紫色石蕊试液,可验证SO2的漂白性 |
| B、构成如图所示装置时,盐桥中的K+向左池移动 |
| C、配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高 |
| D、将10克ZnSO4?7H2O溶解在90克水中配制10%的ZnSO4溶液 |
| n |
| V |
| n |
| V |
| n |
| V |


科目:高中化学 来源: 题型:
| ||
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠的电离:NaHCO3=Na++HCO3- |
| B、将金属钠加入水中:Na+2H2O=Na++2OH-+H2↑ |
| C、硫化钠水解:S2-+2H2O=H2S↑+2OH- |
| D、向氯化铝溶液中加入过量的氨水:Al3++4OH-=Al(OH )4- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO+H2O=Ca(OH)2 |
| B、2Na+2H2O=2NaOH+H2↑ |
| C、Cl2+2H2O=HCl+HClO |
| D、2F2+2H2O=4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、MnO4-、SO42- |
| B、Mg2+、NH4+、SO42-、Cl- |
| C、Na+、Cl-、NO3-、SO42- |
| D、Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24LH2O含有的分子数等于0.1NA |
| B、20g重水(D2 O)所含的电子数为10NA |
| C、标准状况下,2.24LCl2与过量的稀NaOH 溶液反应,转移电子总数为0.2NA |
| D、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
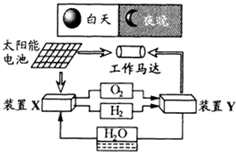 如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )| A、二氧化硅是太阳能电池的光电转换材料 |
| B、装置Y中正极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、装置X能实现燃料电池的氢气和氧气再生 |
| D、装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com