
在温度相同,压强分别为P1和P2的条件下,A(g)+2B(g) 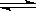 nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是
nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如右图所示,下面结论正确的是
A.P1>P2,n<3 B.P1<P2,n>3
C.P1>P2,n>3 D.P1<P2,n<3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年江西省高一上学期期中测试化学试卷(解析版) 题型:选择题
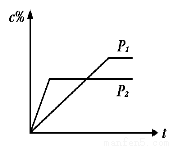
下图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是
A.X、Y均为气体单质
B.X、Y的相对分子质量相等
C.n(H2)<n(X)= n(Y)
D.隔板停止滑动时,A、B、C三部分体积相等
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期第二次月考化学试卷(解析版) 题型:填空题
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
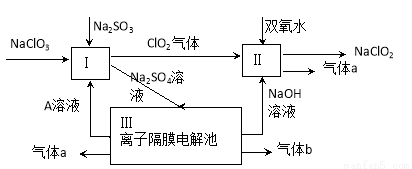
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 。(填“相同”,“不同”或“无法判断”)
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期第二次模拟测试化学试卷(解析版) 题型:选择题
在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+ 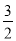 O2(g) = SO2(g)+H2O(g) △H 1
O2(g) = SO2(g)+H2O(g) △H 1
②2H2S(g)+SO2(g) =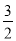 S2(g)+2H2O(g) △H 2
S2(g)+2H2O(g) △H 2
③H2S(g)+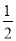 O2(g) = S(g)+H2O(g) △H 3
O2(g) = S(g)+H2O(g) △H 3
④S(g) = 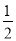 S2(g) △H4
S2(g) △H4
则△H 4的正确表达式为
A.△H 4 =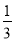 (3△H 3 - △H 1 - △H 2)
(3△H 3 - △H 1 - △H 2)
B. △H 4 =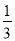 (△H 1 + △H 2 - 3△H 3)
(△H 1 + △H 2 - 3△H 3)
C.△H 4 =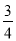 (△H 1 + △H 2 - 3△H 3)
(△H 1 + △H 2 - 3△H 3)
D.△H 4 =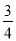 (△H 1 - △H 2 - 3△H 3)
(△H 1 - △H 2 - 3△H 3)
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江大庆实验中学高三上学期期中考试化学试卷(解析版) 题型:填空题
铈、钛、锌、锰虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,反应中CeO2作 剂。在加热条件下,CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________ 。
(2)钛(Ti)被誉为“二十一世纪的金属”。
①在高温下,向金红石(主要成分Ti02)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体。该反应的化学方程式是 。
②加热条件下,镁与TiCl4反应可得到钛,下列气体可以作为保护气的是
A.O2 B.N2 C.C02 D.Ar
(3)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。写出锌和氢氧化钠溶液反应的化学方程式 。
(4)锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料。
①已知A~G各物质间的关系如下图,其中B、D为气态单质。

则反应②的离子方程式为_______________________________________。
②制备Mn02的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。已知:Ksp[Al(OH)3]=1×10-33,pH=7.1时Mn(OH)2开始沉淀。室温下,欲除去MnSO4溶液中的Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:实验题
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100 mL)。
Ⅰ.实验步骤:
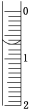
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.100 0 mol/L NAOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
(4)滴定。滴定终点的现象是__________________________________________。
Ⅱ.数据记录:
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) (mL) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NAOH)(消耗) (mL) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理:
某同学在处理数据时计算得:
平均消耗的NAOH溶液的体积V=(15.95+15.00+15.05+14.95)/4 mL=15.24 mL。
(5)指出他的计算的不合理之处:__________________;按正确数据处理,可得市售白醋总酸量=________g/100 mL。(结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源:2015-2016河北石家庄第一中学高一上期中考试化学试卷(解析版) 题型:计算题
(1)8.4g N2与9.6g某单质Rx所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是 ,x值为 。
(2)4.5g水与 g硫酸所含的分子数相等,它们所含氧原子数之比是 ,其中氢原子数之比是 。
(3)如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为___________。

查看答案和解析>>
科目:高中化学 来源:2016届湖南师范大学附属中学高三上月考(四)化学试卷(解析版) 题型:实验题
SO2是常见的大气污染物,燃煤是产生SO2的主要原因。工业上有多种方法可以减少SO2的排放。
(1)往煤中添加一些石灰石,可使燃煤过程中产生的SO2转化成硫酸钙。该反应的总化学方程式是___________________________________。
(2)可用多种溶液做燃煤烟气中SO2的吸收液。
①分别用等物质的量浓度的Na2SO3溶液和NaOH溶液做吸收液,当生成等物质的量NaHS03时,两种吸收液体积比V(Na2SO3): V(NaOH)= 。
②NaOH溶液吸收了足量的:SO2后会失效,可将这种失效的溶液与一定量的石灰水溶液充分反应后过滤,使NaOH溶液再生,再生过程的离子方程式是 。
(3)甲同学认为BaCl2溶液可以做SO2的吸收液。为此甲同学设计如下实验(夹持装置和加热装置略,气密性已检验)。反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B中有白色沉淀。甲同学认为B中白色沉淀是SO2与BaCl2溶液反应生成的BaSO3,所以BaCl2溶液可做SO2 吸收液。
吸收液。
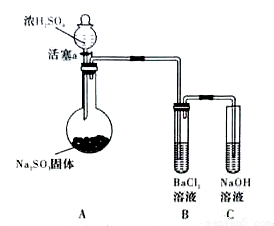
乙同学认为B中的白色沉淀是BaSO4,产生BaSO4的原因是:
①A中产生的白雾是浓硫酸的酸雾,进入B中与BaCI2溶液反应生成BaSO4沉淀。
② 。
为证明 SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如下改动并实验(夹持装置和加热装置略,气密性已检验):
SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如下改动并实验(夹持装置和加热装置略,气密性已检验):

反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B、C试管中除了有气泡外,未见其它现 象;D中红色褪去。
象;D中红色褪去。
③试管B中试剂是 溶液;滴加浓硫酸之前的操作是 。
④通过甲、乙两位同学的实验,得出的结论是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com