
| A. | 25℃由水电离的c(H+)=10-12mol/L 的溶液:Fe3+ Cl- NO3- K+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 某无色溶液:HCO3- NO3- Al3+ Ba2+ | |
| D. | 25℃时,pH=1的溶液:Ba2+ NO3- K+ I- |
分析 A.25℃由水电离的c(H+)=10-12mol/L 的溶液为酸或碱溶液,铁离子能够与氢氧根离子反应;
B.使酚酞变红的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.碳酸氢根离子与铝离子发生双水解反应;
D.pH=1的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化碘离子.
解答 解:A.25℃由水电离的c(H+)=10-12mol/L 的溶液中存在大量氢离子或氢氧根离子,Fe3+与氢氧根离子反应,在碱性溶液中不能大量共存,故A错误;
B.使酚酞变红的溶液为碱性溶液,溶液中存在大量氢氧根离子,Na+、Cl-、SO42-、AlO2-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.HCO3-、Al3+之间发生双水解反应,在溶液中不能大量共存,故C错误;
D.pH=1的溶液为酸性溶液,NO3-、I-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:选择题
| A. | 原子结构示意图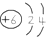 ,可以表示12C原子或13C原子 ,可以表示12C原子或13C原子 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 电子式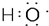 可以表示羟基或氢氧根离子 可以表示羟基或氢氧根离子 | |
| D. | CO2的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
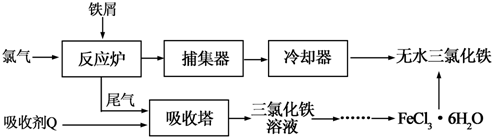
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑦ | B. | 全部 | C. | ③④⑤⑦⑧ | D. | ①②⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
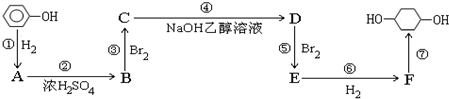
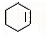 ; F
; F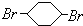 ;
;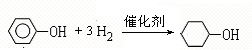 ;
;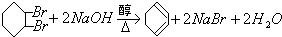 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
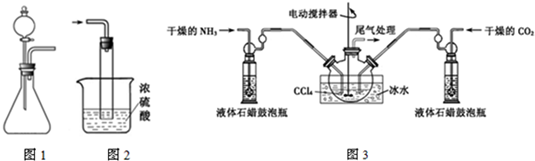
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com