
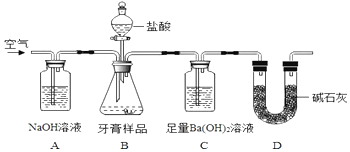
 化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:分析 Ⅰ.(1)氢氧化铝与NaOH溶液反应生成偏铝酸钠与水;往(1)所得滤液中先通入过量二氧化碳,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,再加入过量稀盐酸,Al(OH)3+3HCl=AlCl3+3H2O、HCO3-+H+=CO2↑+H2O;
Ⅱ.(2)实验通过C装置生成的碳酸钡的质量测定二氧化碳的质量,进而计算牙膏中碳酸钙的质量分数.装置中残留部分二氧化碳,不能被完全吸收,导致测定的碳酸钡的质量偏小;
(3)a、在加入盐酸之前,应排净装置内的CO2气体,防止影响碳酸钡质量的测定;
b、滴加盐酸过快CO2,CO2不能完全被吸收,排出装置C;
c、在AB之间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2;
d、在BC之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)2,可以吸收CO2中的HCl,而不影响CO2;
(4)BaCO3质量为3.94g n(BaCO3)=0.0200mol,则n(CaCO3)=0.0200mol,质量为2.00g;
(5)装置B中的水蒸气和氯化氢气体会进入装置C;
(6)将氯化铝溶液和氢氧化钠溶液等体积混合,测得混合溶液中含有铝元素质量与是沉淀中含有铝元素质量的2倍,沉淀为Al(OH)3,溶液中的铝可能为AlCl3或NaAlO2,可分别发生:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,结合反应的离子方程式分为两种情况讨论计算.
解答 解:Ⅰ.(1)氢氧化铝与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为Al(OH)3+OH-═AlO2-+2H2O,往(1)所得滤液中先通入过量二氧化碳,发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,再加入过量稀盐酸,Al(OH)3+3HCl=AlCl3+3H2O,HCO3-+H+=CO2↑+H2O,反应现象是通入CO2气体有白色沉淀生成;加入盐酸有气体产生,沉淀溶解,
故答案为:通入CO2气体有白色沉淀生成,加入盐酸有气体产生,沉淀溶解;
Ⅱ.(2)装置中残留部分二氧化碳,不能被完全吸收,导致测定的碳酸钡的质量偏小,持续缓缓通入空气的作用为:把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收,
故答案为:把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收;
(3)a、在加入盐酸之前,应排净装置内的CO2气体,防止影响碳酸钡质量的测定,可以提高测定准确度,故a不符合;
b、滴加盐酸过快CO2,CO2来不及被吸收,就排出装置C,滴加盐酸不宜过快,使二氧化碳吸收完全,可以提高测定准确度,故b不符合;
c、在AB之间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2,不能提高提高测定准确度,故c符合;
d、在BC之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)2,可以吸收CO2中的HCl,影响CO2,不能提高测定准确度,故d符合;
故选:cd,
故答案为:cd;
(4)BaCO3质量为3.94g,则n(BaCO3)=$\frac{3.94g}{197g/mol}$=0.02mol,则n(CaCO3)=0.02mol,质量为0.02mol×100g/mol=2g,所以样品中碳酸钙的质量分数为$\frac{2g}{8g}$×100%=25%,
故答案为:25%;
(5)B中的水蒸气、氯化氢气体等进入装置C中,导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高.
故答案为:B中的水蒸气、氯化氢气体等进入装置C中.
(6)设AlCl3和NaOH的浓度分别为c1和c2,相同体积为V,
①若NaOH稍多一些,生成部分NaAlO2,此时参加反应的AlCl3的物质的量是c1Vmol,则完全沉淀消耗NaOH是3c1Vmol,生成c1V mol 的Al(OH)3,又因为混合溶液中含有铝元素质量与是沉淀中含有铝元素质量的2倍,则根据铝守恒,说明有$\frac{2}{3}$的氢氧化铝溶解生成偏铝酸根,剩余$\frac{1}{3}$氢氧化铝沉淀,发生Al(OH)3+OH-=AlO2-+2H2O反应,所以根据反应则又消耗了$\frac{2}{3}$c1Vmol的氢氧化钠,所以一共消耗的NaOH的物质的量为:3c1V+$\frac{2}{3}$c1V=$\frac{11}{3}$c1V=c2V,所以c1:c2=3:11;
②当氯化铝过量时,氢氧化钠不足,生成氢氧化铝白色沉淀发生反应:Al3++3OH-═Al(OH)3↓,设反应掉的铝离子物质的量为x,得到的沉淀物中铝元素的质量是所得溶液中铝元素的质量的0.5倍,则0.5(c1V-x)=x,所以x=$\frac{1}{3}$c1V,消耗氢氧化钠3x,即c1Vmol,所以c1V=c2V,所以此时c1:c2=1:1,所以原AlCl3溶液和NaOH溶液物质的量浓度之比可能是3:11或者1:1,
故答案为:3:11或者1:1.
点评 本题考查对实验原理与操作步骤的理解及评价、常用化学用语、化学计算、物质组成的测定等,难度中等,是对所需知识的综合运用,需要学生具有扎实的基础知识与分析问题、解决问题的能力,理解实验原理是解答的关键.


科目:高中化学 来源: 题型:选择题
| A. | NO:0.001 mol•L-1 | B. | H2O:0.002 mol•L-1 | ||
| C. | NH3:0.002 mol•L-1 | D. | O2:0.001 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.4mol/(L•s) | B. | v(C)=30mol/(L•min) | C. | v(A)=0.15mol/(L•s) | D. | v(B)=0.9mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学事实 | 类推结论 | |
| A | 卤素单质的沸点:F2<Cl2<Br2<Iz2 | 氢化物沸点:FH<HCI<HBr<HI |
| B | 用电解熔融MgCI2可制得金属 | 用电解熔融NaCI也可以制取金属钠 |
| C | 将CO:通入Ba(NO3)2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| D | AI与S加热时直接化合生成AI2S3 | Fe与S加热时也能直接化合生Fe2S3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在日常生活中,电化腐蚀是造成钢铁腐蚀的主要原因 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| C. | SO2具有漂白性,可用于漂白纸浆,但不可以用于漂白食品 | |
| D. | 纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷中混有乙烯,将其通入酸性高锰酸钾溶液中洗气 | |
| B. | 乙烯中混有二氧化硫,将其通入氢氧化钠溶液中洗气 | |
| C. | 乙炔中混有硫化氢,将其通入溴水中洗气 | |
| D. | 溴苯中混有溴,加入汽油,振荡,用汽油萃取出溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能使酸性KMnO4溶液、溴水、品红溶液褪色,且原理相同 | |
| B. | 不能用澄清石灰水鉴别SO2和CO2 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| D. | 少量SO2通过浓的CaCl2溶液能生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
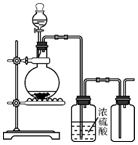
| A. | 铜和稀硝酸制一氧化氮 | B. | 亚硫酸钠与硫酸制二氧化硫 | ||
| C. | 锌和稀硫酸制氢气 | D. | 硫化亚铁与稀硫酸制硫化氢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com