
| A. | 全部可以 | B. | 仅②可以 | C. | 仅②③可以 | D. | ①③④可以 |
分析 能判断金属元素甲的金属性一定比乙强的事实:单质之间的置换反应;原子的失电子能力大小;根据元素周期律:同周期元素的金属性从左到右逐渐减弱,同主族元素的金属性从下到上逐渐减弱.
解答 解:①甲单质能与乙盐的溶液反应并置换出乙,能判断金属元素甲的金属性一定比乙强,故正确;
②氢和钠的最外层有1个电子,且氢的原子半径小于钠的原子半径,氢是非金属而钠是金属,故错误;
③甲、乙两短周期元素原子的电子层数相同,即相同周期的元素,原子序数越小,元素的金属性越强,故正确;
④元素的最高价氧化物水化物的碱性越强,则元素的金属性越强,故正确.
故选D.
点评 本题考查元素周期律应用,掌握金属性、非金属性强弱比较实验事实,注意利用反例法进行解答,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的原子半径、失电子能力随核电荷数的增加而增大 | |
| B. | 被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 | |
| C. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| D. | 单质的颜色随核电荷数的增加而加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
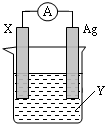 依据氧化还原反应:2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径为20 nm的纳米碳酸钙属于胶体 | |
| B. | 海水中提取镁的各步反应均为氧化还原反应 | |
| C. | 光导纤维是一种新型硅酸盐材料 | |
| D. | 可溶性铁盐和铝盐可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子和Y原子最外层都只有一个电子 | |
| B. | X原子2p能级上有三个电子,Y原子的3p能级上有三个电子 | |
| C. | X原子的核外电子排布为1s2,Y原子的核外电子排布为1s22s2 | |
| D. | X原子核外M层上仅有两个电子,Y原子核外N层上仅有两个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将浓硝酸分别放在冷暗处和强光照射下,会发现强光照可以加快浓硝酸的分解 | |
| B. | 在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 | |
| C. | 将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大 | |
| D. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,另一支试管不加;同时加热,产生氧气的快慢不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com