
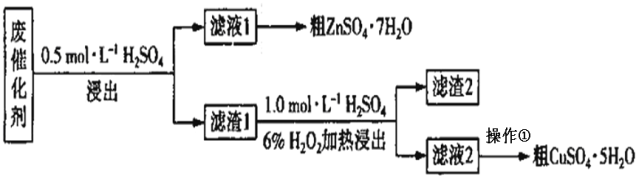
����Ŀ��ij�ϴ�����SiO2��ZnO��ZnS��CuS��ʵ���ҴӸ÷ϴ����л���п��ͭ��һ����������ͼ��ʾ��
����ʹ�õ�װ����ͼ��ʾ���ش��������⣺
 ����Ũ������ȴ�ᾧ����Ũ������ȴ�ᾧ
����Ũ������ȴ�ᾧ����Ũ������ȴ�ᾧ
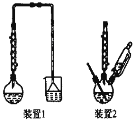
(1)��һ�ν�������ѡ��װ�� _______(����1������2��)��ԭ���� ________������1����Ҫ�ɷ���_______��
(2)�ڶ��ν���ʱ���ɵ�����д����Ӧ�����ӷ���ʽ��_______________���ò��輴ʹ�����¶Ȳ���Ҳ���ܻ��и���Ӧ����������֮һ�ǿ�������Ҫ�ɷ֣���������ԭ����_____________________ ��
(3)����Һ2�еõ�CuSO4��5H2O�IJ����� __________ �����ˡ�ϴ�ӡ�
(4)�����������漰����������е��������١���ͬ��������_____________ ��
A.�������������ű����������һ�գ���ˮ���գ���ȡ֭������֮��
B.���������塷�о�����˪�������������û��ϣ�������֮���������Ϸ��Ÿ�����
C.���������ݡ��л�ȡ����أ������µ�����˪��ɨȡ��ˮ��֭���˼���������
D. �����ݸ�Ŀ�����վƵ����칤�գ������ỵ֮�ƣ��Կ�������
(5)���÷ϴ����к�12.8%��CuS��ʵ���г�ȡ15.0g�ϴ������յõ�3.0gCuSO4��5H2O����ͭ�Ļ�����Ϊ __________________ ��
���𰸡�1 ���ж�����H2S���ɣ�װ��2û��β������װ�� SiO2��CuS CuS+H2O2+2H+=Cu2++2H2O+S Cu2+��H2O2�ֽ����O2 ����Ũ������ȴ�ᾧ C 60.0%
��������
�ϴ�������ϡ���ᣬ��һ�ν�����Ҫ������Ӧ��ZnO��H2SO4��ZnSO4��H2O��ZnS��H2SO4��ZnSO4��H2S����Fe3O4��4H2SO4��FeSO4��Fe2(SO4)3��4H2O�����˺���Һ��ZnSO4��FeSO4��Fe2(SO4)3��Ũ���ᾧ�õ���ZnSO47H2O������1����SiO2��CuS����ʢ������1�ķ�Ӧ���м�H2SO4��H2O2��Һ������������ԭ��Ӧ����������ͭ��������2������Ͷ������裬��Һ��������ͭ����Ũ����ᾧ�ɵõ�����ͭ���塣
(1)������Ŀ��ѧ��������֪����һ�ν���������Ӧ��ZnO��H2SO4��ZnSO4��H2O��ZnS��H2SO4��ZnSO4��H2S�������ж�������H2S���ɣ�����������������Һ����β����������װ��2û��β������װ�ã����ѡ1װ�ã� �����е�SiO2��CuS���������ᣬ���������Ӧ���ս�������1��
�ʴ�Ϊ��1�����ж�����H2S���ɣ�װ��2û��β������װ�ã�SiO2��CuS��
(2) �ڶ��ν���ʱ������Ӧ�Ļ�ѧ����ʽ��CuS��H2O2��H2SO4�TCuSO4��S��2H2O����Ӧ�����ӷ���ʽΪ��CuS+H2O2+2H+=Cu2++2H2O+S����Ϊ�������ⲻ�ȶ�����ͭ���Ӵ������»�ֽ������������˼�ʹ�����¶Ȳ���Ҳ���ܻ��и���Ӧ������
�ʴ�Ϊ��CuS+H2O2+2H+=Cu2++2H2O+S��Cu2+��H2O2�ֽ����O2��
(3)��Һ2��Ҫ����������ͭ�����еõ�����ͭ���壬Ӧ���ý��½ᾧ�����������������Ũ������ȴ�ᾧ����ˡ�ϴ�ӵõ�����ͭ���壬
�ʴ�Ϊ������Ũ������ȴ�ᾧ��
(4)A.��ȡ�����صĹ�������������ȡ���ʲ�ѡ��
B.��˪�����Ժ��������Ľ��,���ַ��뷽�����������ʲ�ѡ��
C.����ص��ܽ�����¶ȱ仯���ᴿ�ķ������ȼ�ˮ�ܽ⣬Ȼ�������ᾧ�õ�����ؾ��壬�����1��ͬ����ѡ��
D.�ù����漰����������������ʲ�ѡ��
�ʴ�Ϊ��C��
(5) �ϴ�����Cu�����ʵ���Ϊ15.0g��12.8%��96g/mol��0.02mol��3.0g CuSO4�q5H2O��Cu�����ʺ�����Ϊ3.0g��250g/mol��0.012mol����ͭ�Ļ�����Ϊ![]() ��100%��60%��
��100%��60%��
�ʴ�Ϊ��60%��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
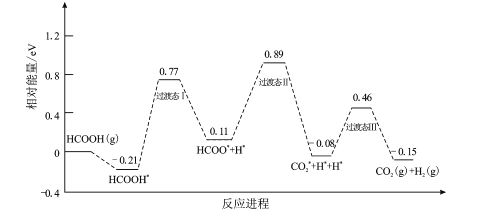
����Ŀ�����ᱻ��Ϊ��������������壬�ҹ��Ƽ�����������DFT�����о�������HCOOH�ڴ�������ֽ����H2�ķ�Ӧ������ͼ��ʾ�����������ڴ��������������*��ע
�ش��������⣺
(1)�������о��ٲ��������(���)E��=__________eV���ò���ķ�Ӧ����ʽΪ__________
(2)����ֽ����������Ȼ�ѧ����ʽΪ__________
(3)���¶�Ϊ383KѹǿΪp0ʱ����һ������HCOOH�������һ��ʢ�д����ĸ��������У��ﵽƽ��ʱ��H2�ķ�ѹΪ0.55p0����÷�Ӧ��(HCOOH)=______________�����¶��µ�ѹǿƽ�ⳣ��Kp=__________ (����������2λ��Ч����)
(4)HCOOH�ķֽ���ڸ���ӦHCOOH(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
��֪H2��ѡ����=![]() �ܹ�����H2ѡ���ԵĿ��ܷ�����____
�ܹ�����H2ѡ���ԵĿ��ܷ�����____
(5)������Ϊֱ��ȼ�ϵ�ص�ȼ�Ͼ��������ܶȸߵ��ŵ����������Һ�����ԣ�����ֱ��ȼ�ϵ�صĸ�����ӦʽΪ__________���õ�ص����������ѹΪ1.48V�������ܶ�E=________kW��h/kg(�����ܶ�=����������/ȼ��������1kW��h=3.6��106J)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ж��У���ȷ���ǣ� ��
A.��ĭ����������ԭ����2Al3++3CO32-+3H2O��2Al(OH)3��+3CO2��
B.��CH3COONa��Һ��20��������30�棬��Һ��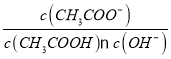 ����
����
C.ij���ʵ���Һ����ˮ�������c(H+)= 1��10-a mol/L����a>7ʱ,�����Һ��pHһ��Ϊ14-a
D.��֪25��ʱNH4CN�Լ��ԣ���25��ʱ�ĵ��볣��K��NH3��H2O����K��HCN��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����з�Ӧ�Ļ�ѧ����ʽ�����ֱ���˫���ŷ��͵����ŷ���ʾ����ת�Ƶķ������Ŀ��
��1����������ԭ����ͭ��__��__��
��2����������طֽ���ȡ������__��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1) �ں�Fe3+��S2O![]() ��I-�Ļ����Һ�У���ӦS2O
��I-�Ļ����Һ�У���ӦS2O![]() (aq) + 2I-(aq)=2SO
(aq) + 2I-(aq)=2SO![]() (aq) + I2(aq)�ķֽ��������Ӧ�����е������仯��ͼ��ʾ��
(aq) + I2(aq)�ķֽ��������Ӧ�����е������仯��ͼ��ʾ��
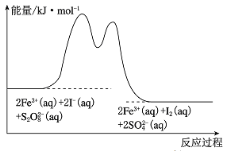
��������2Fe3+(aq) + 2I-(aq) = I2(aq)+ 2Fe2+(aq)
��������2Fe2+(aq) + S2O![]() (aq) = 2Fe3+(aq) + 2SO
(aq) = 2Fe3+(aq) + 2SO![]() (aq)
(aq)
�����йظ÷�Ӧ��˵������ȷ���� _______��
A. �÷�ӦΪ���ȷ�Ӧ
B. Fe3+�Ǹ÷�Ӧ�Ĵ���������߷�Ӧ��ϵ�л���Ӱٷ���
C. ��Ӧ����v(S2O![]() )=2v(SO
)=2v(SO![]() )
)
D. ������Fe3+��������Ӧ�Ļ�ܱ��淴Ӧ�Ĵ�
(2)һ�������£���ҵ�Ͽɲ���CH3OH��CO+2H2�ķ�������ȡ�ߴ��ȵ�CO��H2���ҹ�ѧ�߲���������ѧ������ͨ�������ģ�⣬�о������ٻ���������״�����ķ�Ӧ���̣������������ٴ��������ϵ�������*��ע��
�� �״����ⷴӦ�ĵ�һ�����̣������ֿ��ܷ�ʽ��
��ʽA��CH3OH*��CH3O*+H* Ea=+103.1kJ��mol-1 ��ʽB��CH3OH*��CH3*+OH* Eb=+249.3kJ��mol-1
�ɻ��Eֵ�Ʋ⣬�״��ѽ������Ҫ�����ķ�ʽӦΪ_____________��(����A������B��)
����ͼΪ�����ģ��ĸ�����Ӧ�������仯ʾ��ͼ��

�������У��������IJ���Ļ�ѧ����ʽΪ ________________________________ ��
(3)��֪298Kʱ��A��B�ֱ�Ϊ��ɫ���塢��ɫ���壬������Ӧ��A(g)![]() 2B(g)
2B(g)
����Ӧ��ƽ�������������������ٴδﵽƽ��ʱ����������ɫ ____(����������������dz������������)��
�������ܱ������з���������Ӧ����֪v��=k����p(A)��v��=k����p2(B)��Kp=____________ ��(��k����k����ʾ)������ʼѹǿΪ100kPa��k��=2.8��104 s-1����B���������Ϊ40%ʱ��v��= _____kPa��s-1[����p(A)��p(B)�ֱ���A��B�ķ�ѹ�� ��ѹ=p�����������������k����k��Ϊ���ʳ���]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к͵ζ�
��1������ʽ�ζ�����ȡ20.00 mL����ϡ������Һ������ƿ�У����μ�1��2�η�̪��ָʾ������0.20 mol��L-1NaOH����Һ���еζ���Ϊ�˼�Сʵ������ͬѧһ������������ʵ�飬����ÿ����ȡϡ���������Ϊ20��00 mL������ʵ������¼���£�
ʵ����� | ��һ�� | �ڶ��� | ������ |
����NaOH��Һ���/mL | 19.00 | 23.00 | 23.02 |
�������Ũ��ԼΪ_____________(������λ��Ч����)���ζ��ﵽ�յ�ı�־��_____________��
��2��������ʵ���У����в���������������ȷ������ɲⶨ���ƫ�ߵ���_______��
A. �ζ��յ����ʱ���Ӷ���
B. ��ʽ�ζ���ʹ��ǰ��ˮϴ��δ�ô���������ϴ
C. ��ƿˮϴ��δ����
D. ����NaOH����Һʱ��û�е��ܽ�Һ�������¾�ת��������ƿ��
E. ����NaOH����Һʱ������ʱ��������ƿ�Ŀ̶���
F. ��ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ
������1���ڴ���CuSO4��5H2O�����г���������Fe2+�����ᴿʱΪ�˳�ȥFe2+�������������������ʹFe2+����ΪFe3+���������ʿɲ��õ���________
A. KMnO4 �� B. H2O2 ���� C. ��ˮ ���� D. HNO3
��2��Ȼ���ټ����ʵ����ʵ�������ҺpH=4��ʹFe3+ת��ΪFe(OH)3�����Դﵽ��ȥFe3+������ʧCuSO4��Ŀ�ģ�������ҺpH��ѡ�������е�_______��
A. NaOH B. NH3��H2O C. CuO D. Cu(OH)2
��3��������Fe(OH)3���ܶȻ�Ksp=8.0��10-38,Cu(OH)2���ܶȻ�Ksp=3.0��10-20��ͨ����Ϊ��������Һ�е�����Ũ��С��1��10-5 mol��L-1ʱ����Ϊ������ȫ������Һ��CuSO4��Ũ��Ϊ3.0 mol��L-1����Cu(OH)2��ʼ����ʱ��Һ��pHΪ_______��Fe3+��ȫ����ʱ��Һ��pHΪ________����֪ lg5 = 0.7 )
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�м�����Ƭ�����������������Һ��һ���ܴ����������������
A.![]() ��
��![]() ��
��![]() ��
��![]()
B.![]() ��
��![]() ��
��![]() ��
��![]()
C.![]() ��
��![]() ��
��![]() ��
��![]()
D.![]() ��
��![]() ��
��![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ���ǣ� ��
A.��Ӧ��������������������������ʱ���÷�Ӧһ�����ܷ���
B.��10lkPa��120��ʱ��1gH2��ȫȼ��������̬ˮ���ų�120.9kJ����������1mol������10lkPa��25��ʱȼ�շų�������ӦС��241.8kJ
C.��֪��2SO2(g)+O2(g)![]() 2SO3(g)����H=��98.3kJ/mol����1molSO2��0.5molO2����һ�ܱ������з�Ӧ���ų�49.15kJ������
2SO3(g)����H=��98.3kJ/mol����1molSO2��0.5molO2����һ�ܱ������з�Ӧ���ų�49.15kJ������
D.��ʯī�Ƚ��ʯ�ȶ���֪��C�����ʯ��s��= C(ʯī��s)����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2A(g)+B(g)![]() 3C(g)+4D(g)�У���ʾ�÷�Ӧ����������:
3C(g)+4D(g)�У���ʾ�÷�Ӧ����������:
A.V(A)=0.5mol��L-1��s-1B.V(B)=0.3mol��L-1��s-1
C.V(C)=0.8mol��L-1��s-1D.V(D)=1mol��L-1��s-1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com