

分析 (1)增大接触可以提高浸出效率,如搅拌、将氧化锌粉碎等;
(2)Mn元素化合价由MnO4-中+7价降低为MnO2中+4价,共降低3价,Fe元素化合价由Fe3+中+2价升高为Fe(OH)3中+1价,共升高1价,化合价升降最小公倍数为3,则MnO4-的系数为1,Fe3+的系数为3,由原子守恒可知缺项为水,再结合原子守恒、电荷守恒配平;
(3)调节溶液pH,除去溶液中Cu2+、Ni2+、Cd2+等;
(4)①溶液中c(Fe3+)=0.56mg.L-1,物质的量浓度为10-5mol/L,溶液pH=3,则溶液中c(OH-)=10-11mol/L,计算浓度积Qc,与溶度积Ksp[Fe(OH)3]=4.0×10-38比较判断;
②Fe2+转化为Fe(OH)3,Mn2+转化为MnO2,根据电子转移守恒计算需要高锰酸钾的物质的量,进而计算需要高锰酸钾的质量.
解答 解:(1)搅拌、将氧化锌粉碎等可以充分接触,可以提高浸出效率,
故答案为:搅拌、将氧化锌粉碎;
(2)Mn元素化合价由MnO4-中+7价降低为MnO2中+4价,共降低3价,Fe元素化合价由Fe3+中+2价升高为Fe(OH)3中+1价,共升高1价,化合价升降最小公倍数为3,则MnO4-的系数为1,Fe3+的系数为3,由原子守恒可知缺项为水,再结合原子守恒、电荷守恒配平:MnO4-+3Fe2++7H2O═MnO2↓+3Fe(OH)3↓+5H+,
故答案为:1;3;7H2O;1;3;5;
(3)加入锌粉的目的是:调节溶液pH,除去溶液中Cu2+、Ni2+、Cd2+等,
故答案为:调节溶液pH,除去溶液中Cu2+、Ni2+、Cd2+等;
(4)①溶液中c(Fe3+)=0.56mg.L-1,物质的量浓度为10-5mol/L,溶液pH=3,则溶液中c(OH-)=10-11mol/L,10-5×(10-11)3=1×10-38<Ksp[Fe(OH)3]=4.0×10-38,此时Fe3+ 不能发生沉淀,
故答案为:不能;
②浸出液中c(Fe3+)=5.04mg.L-1=5.04g/m3,c(Mn2+)=1.65mg.L-1=1.65g/m3,1m3上述浸出液中,Fe2+的物质的量为$\frac{1{m}^{3}×5.04g/{m}^{3}}{56g/mol}$=0.09mol,Mn2+的物质的量为$\frac{1{m}^{3}×1.65g/{m}^{3}}{55g/mol}$=0.03mol,Fe2+转化为Fe(OH)3,Mn2+转化为MnO2,根据电子转移守恒,需要高锰酸钾的物质的量为$\frac{0.09mol×1+0.03mol×2}{7-4}$=0.05mol,需要高锰酸钾的质量为0.05mol×158g/mol=7.9g,
故答案为:7.9.
点评 本题属于化学工艺流程题目,涉及对操作的分析评价、物质的分离提纯、氧化还原反应配平与计算、溶度积有关计算等,是对学生综合能力的考查,为高考常考题型,难度中等.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:解答题
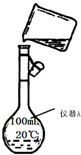 化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合右侧下列实验装置图回答有关问题:
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的.结合右侧下列实验装置图回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、氯化钙 | B. | 盐酸、烧碱、小苏打 | ||
| C. | 碳酸、乙醇、醋酸钠 | D. | 磷酸、熟石灰、过氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | l L pH=l的硫酸溶液中含有的H+ 数为0.2NA | |
| C. | 78 g Na202固体中含有的阴离子数为2NA | |
| D. | 500 mL 2 mol.L-l FeCl2溶液中Fe3+数为NA,且$\frac{n(C{l}^{-})}{n(F{e}^{3+})}$=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 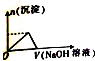 | B. | 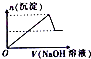 | C. | 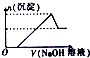 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | Na2O2 | C. | CuO | D. | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要摄入反式脂肪酸,就一定会患上心血管疾病 | |
| B. | 氢化是一种把液态植物油转化成固态或半固态脂肪的化学工艺 | |
| C. | 奶油、代可可脂巧克力、乳饮料、奶茶、蛋黄派等零食都可能含有反式脂肪酸 | |
| D. | 食品标签里的氢化植物油、植脂末、起酥油、代可可脂等都可能是反式脂肪酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.20 | 20.22 |
| 第二次 | 25.00 | 0.56 | 24.54 |
| 第三次 | 25.00 | 0.42 | 20.40 |
| A. | 0.0853mol/L | B. | 0.1000mol/L | C. | 0.0800mol/L | D. | 0.1250mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
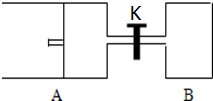 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L.在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0达到平衡时,V(A)=1.2aL.试回答:
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时,V(A)=V(B)=a L.在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g)△H<0达到平衡时,V(A)=1.2aL.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com