
| A. | 1.0 mol/L | B. | 2.0 mol/L | C. | 3.0 mol/L | D. | 4.0 mol/L |
分析 根据稀释定律计算混合后溶液中c(SO42-),向混合溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余,说明溶液中溶质为FeSO4,根据硫酸根守恒c(FeSO4)=c(SO42-).
解答 解:把1.0mol/LCuSO4和1.0mol/L Fe2(SO4)3溶液等体积混合,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=$\frac{1}{2}$×1.0mol/L=0.5mol/L,c(H2SO4)=$\frac{1}{2}$×1.0mol/L=0.5mol/L,
混合后溶液中硫酸根来源于硫酸铜与硫酸铁电离,故 c(SO42-)=c(CuSO4)+3c[Fe2(SO4)3]=0.5mol/L+3×0.5mol/L=2mol/L,向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=2mol/L,
故选:B.
点评 本题考查物质的量浓度的有关计算,难度中等,注意对公式的理解与灵活运用,注意守恒思想的运用.


科目:高中化学 来源: 题型:选择题
 某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是( )
某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是( )| A. | 该有机物遇氯化铁溶液不呈紫色 | |
| B. | 1mol该有机物能与6mol氢氧化钠反应 | |
| C. | 该有机物能与6mol金属钠反应生成6molH2 | |
| D. | 在稀硫酸存在下可以发生水解反应,但水解的产物只有一种有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
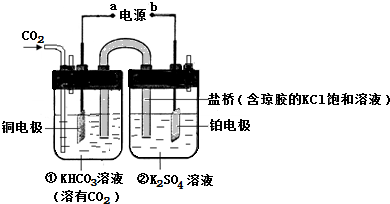
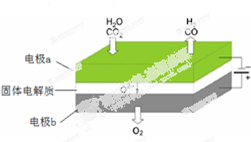
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
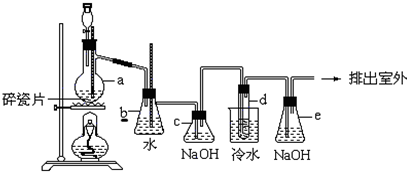
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液:K+、Ca2+、HCO3-、NO3- | |
| B. | 存在较多的Na+、SO42-、OH-、的溶液中:Mg2+、Ba2+、Br- | |
| C. | 使紫色石蕊变蓝的溶液:K+、Na+、CH3COO-、SO42- | |
| D. | 由水电离出的c(H+)为1×10-10 mol/L溶液中:K+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-12mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液:K+、HCO3-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 物质 | 杂质(少量) | 试 剂 | 除杂操作方法 |
| (1) | Na2CO3固体 | NaHCO3 | - | |
| (2) | Fe | Al | ||
| (3) | FeSO4 | CuSO4 | ||
| (4) | NaOH | Na2CO3 | ||
| (5) | KNO3 | NaCl | - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com