
| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C5H12 | 3 |
| B | 分子式为C5H10,能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C4H10O,能与Na反应生成氢气 | 4 |
| D | 分子式为C4H8O2,能与NaHCO3反应 | 3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、戊烷有3种同分异构体;
B、能使溴的四氯化碳溶液褪色,说明为戊烯,据此解答即可;
C、能与Na反应生成氢气,说明为醇类,依据丁基的个数判断即可;
D、能与NaHCO3反应说明为羧酸,依据丁烯基的个数判断即可.
解答 解:A、戊烷有3种同分异构体,分别为正戊烷、异戊烷与新戊烷,故A正确;
B、能使溴的四氯化碳溶液褪色,说明为戊烯,分别为1-戊烯、2-戊烯、2-甲基-1-丁烯、2-甲基-2-丁烯、3-甲基-1-丁烯,故总共有5种,故B正确;
C、能与Na反应生成氢气,说明为醇类,C4H10O可写成C4H9OH,丁基的个数为4,故总共应有4种醇,故C正确;
D、能与NaHCO3反应说明为羧酸,C4H8O2可写成C3H7COOH,丙基有2种,故D错误,故选D.
点评 本题主要考查的是同分异构体数目的判断,掌握碳原子数小于5的烷烃基的个数是解决本题的关键,难度不大,甲基和乙基各1个,丙基2个,丁基4个,戊基8个.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:F>Cl>Br | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数都相同 | D. | 最外层电子数依次增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
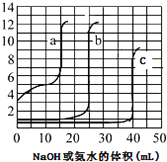 取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )
取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )| A. | 由图可知曲线c为NaOH滴定硫酸 | |
| B. | 由图可知硫酸的物质的量浓度大于盐酸的物质的量浓度 | |
| C. | 曲线b、c的滴定实验可用酚酞做指示剂 | |
| D. | 由图可知滴定前醋酸电离度约为1.67% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向烧碱溶液中通入少量的二氧化碳 2OH-+CO2=CO32-+H2O | |
| B. | 向氯化铝溶液中滴加过量浓氨水 Al3++3OH-═Al(OH)3↓ | |
| C. | 向水玻璃中通入少量二氧化碳 SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| D. | 铝与氢氧化钠溶液反应 2Al+2OH-+6H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H12有2种同分异构体 | |
| B. | C8H10中只有三种属于芳香烃的同分异构体 | |
| C. | CH3CH2CH2CH3光照下与氯气反应,只生成一种一氯代烃 | |
| D. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使紫色石蕊溶液变红色:SO2+H2O=2H++SO32- | |
| B. | 利用NaOH溶液除去金属铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| C. | 向淀粉碘化钾溶液中加稀硫酸,在空气中放置一段时间后变蓝:4H++4I-+O2=2I2+2H20 | |
| D. | 用盐酸洗涤试管中的Cu(OH)2:Cu(OH)2+2H+=Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌片做负极,锌发生氧化反应 | B. | 铜片做正极 | ||
| C. | 溶液中的pH值增大 | D. | 溶液中的H+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com