
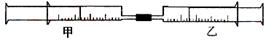
| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 40 mL HCl | 40 mLNH3 | 产生白烟 |
| 2 | 40 mL Cl2 | 10mL 水 | 剩余气体为20mL |
| 3 | 30 mL NO | 15 mL O2 | |
| 4 | 20 mL AlCl3溶液 | 10 mL NaOH溶液 | 生成白色沉淀,后消失 |



科目:高中化学 来源:不详 题型:单选题
 NH3 + HCl类推NH4NO3
NH3 + HCl类推NH4NO3  NH3 + HNO3
NH3 + HNO3| A.②和③ | B.仅有③ | C.仅有④ | D.以上都错 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验事实 | 结论 |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | 将CO2通入NaAlO2溶液会产生白色沉淀 | 结合H+的能力:HCO3-<AlO2- |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.④⑤ | C.①② | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.漂白粉长时间露置空气中会变质失效 |
| B.澄清石灰水可用来鉴别Na2CO3和NaHCO3溶液 |
| C.高温下SiO2能与Na2CO3反应放出CO2,但不能说明H2SiO3的酸性强于H2CO3 |
| D.金属的化学腐蚀和电化学腐蚀的本质相同,但电化学腐蚀伴有电流产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Cl2有氧化性 | Cl2能使湿润的红色布条褪色 |
| B | SO2有漂白性 | SO2能使酸性KMnO4溶液褪色 |
| C | Al有还原性 | 利用铝热反应冶炼金属Mn |
| D | Fe3+有氧化性 | Fe3+遇KSCN溶液显血红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 现象 | 解释 |
| A. | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B. | 浓HNO3在光照条件下变黄 | 浓硝酸不稳定,生成有色产物能溶于浓硝酸 |
| C. | 某溶液中加入硝酸酸化的氯化钡溶液, 有白色沉淀生成 | 说明该溶液中含有SO42- |
| D. | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2NO2→HNO3→NO | B.Na→Na2O→Na2O2→Na2CO3 |
| C.S→SO3→H2SO4→SO2 | D.Si→SiO2→H2SiO3→Na2SiO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl2、Al(NO3)3、SO2、SiO2 | B.CO、Al、NaHCO3、N2O5 |
| C.SiO2、NH4HCO3、SO3、CO2 | D.CaO、CO2、Cl2、NH4Al(SO4)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com