
分析 每个碳原子有4个价键,对于烃CxHy分子,除了氢原子之外就是碳与碳之间的共用电子对,由于每两个碳共用这些电子对,因此碳与碳之间的共用电子对数为:$\frac{4x-y}{2}$,利用此公式代入即可求解即可.
解答 解:每个碳原子有4个价键,对于烃CxHy分子,除了氢原子之外就是碳与碳之间的共用电子对,由于每两个碳共用这些电子对,因此碳与碳之间的共用电子对数为:$\frac{4x-y}{2}$,
(1)分子式为CnH2n-6的烃分子中碳碳间共用电子对数为:$\frac{4x-y}{2}$=$\frac{4n-(2n-6)}{2}$=n+3;
故答案为:n+3;
(2)若某物质分子中碳碳间共用电子对数为160,则Cx相当于CxHy分子中y=0,则:$\frac{4x}{2}$=160,解得:x=80,Cx的分子式为C80;
故答案为:C80.
点评 本题考查了有机物分子式的确定,题目难度中等,明确烃CxHy分子中碳与碳之间的共用电子对数为$\frac{4x-y}{2}$为解答关键,试题培养了学生的分析、归纳能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | ②③①④ | B. | ③②①④ | C. | ③①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 现有一瓶葡萄糖(C6H12O6)溶液,部分标签如图所示,请列式计算,
现有一瓶葡萄糖(C6H12O6)溶液,部分标签如图所示,请列式计算,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8 g甲烷中含C-H键的数目为4NA | |
| B. | 标准状况下,22.4L乙醇的分子数为NA | |
| C. | 1 mol冰醋酸和1 mol乙醇经催化加热反应生成H2O分子数为NA | |
| D. | 标准状况下,16g甲烷分子所含质子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
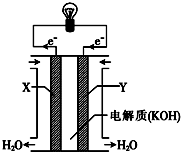 一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:
一个完整的氧化还原反应的方程式可以拆开,写成两个“半反应式”,一个是氧化反应式,另一个是还原反应式.如2Fe3++Cu═2Fe2++Cu2+的拆写结果是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研制开发燃料电池汽车,消除机动车尾气污染 | |
| B. | 乙醇和汽油都是可再生资源,应大力推广使用“乙醇汽油” | |
| C. | 加入明矾使海水中的盐分沉淀可以使海水淡化,解决“淡水供应危机” | |
| D. | 要尽快发现地球上的有用物质,加大开采速度,加快社会发展 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com