
下列类比关系正确的是
A.AlCl3与过量NaOH溶液反应生成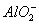 ,则与过量NH3·H2O也生成
,则与过量NH3·H2O也生成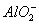
B.Na 2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2
2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应
科目:高中化学 来源: 题型:
G是一种合成橡胶和树脂的重要原料,A是C、H、O三种元素组成的五元环状化合物,相对分子质量为98,其核磁共振氢谱只有一个峰;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3。已知:(其中R是烃基)

有关物质的转化关系如下图所示,请回答以下问题。
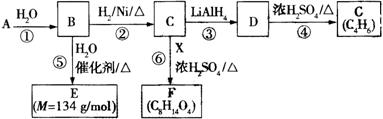
(1)A中不含氧的官能团的名称是 ;⑤的反应类型是 。G的结构简式为 ;G与Br2的CCl4溶液反应,产物有 种(不考虑立体异构)。
(2)反应②的化学方程式为 。
(3)E可在一定条件下通过 (填反应类型)生成高分子化合物,写出该高分子化合物可能的结构简式: (两种即可)。
(4)反应⑥的化学方程式为 。
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简式: 。Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列 表示对应化学反应的离子方程式正确的是
表示对应化学反应的离子方程式正确的是
A.用白醋除铁锈:Fe2O3+6H+===3H2O+2Fe3+
B.向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:
Ba2++ 2OH-+NH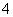 + HCO
+ HCO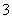
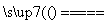 NH3↑+2H2O+BaCO3↓
NH3↑+2H2O+BaCO3↓
C.用过量冷氨水吸收SO2:SO2+NH3·H2O===HSO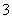 +NH
+NH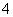
D. 用强碱吸收工业制取硝酸尾气:NO+ NO2+2OH-===2NO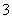 +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
五种短周期元素的某些性质如下表所示:
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12 m) | 37 | 99 | 66 | 104 | 154 |
| 主要化合价 | +1 | -1、+7 | -2 | -2、+6 | +1 |
下列说法正确的是( )
A.由Q与Y形成的化合物中只存在离子键
B.Z与X之间形成的化合物具有还原性
C.X、Y元素组成的化合物的沸点高于X、Z元素组成化合物的沸点是由于Y非金属性比Z强
D.Y、Q、W三种元素组成化合物的水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
化学知识在生产和生活中有着重要的应用。下列说法中正确的是
①钠的还原性很强,可以用来冶炼金属钛、钽、铌、锆等
②K、Na合金可作原子反应堆的导热剂
③发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
④Na2O2既可作呼吸面具中O2的来源,又可漂白织物、麦杆、羽毛等
⑤碳酸钠在医疗上是治疗胃酸过多的一种药剂
A.①②③④ B.②③④⑤ C.①②③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
铁、铝、铜及其化合物在生产、生活中有广泛的用途。试回答下列问题:
(1)铝的原子结构示意图为________;铁、铝、铜三种金属的金属活动性由弱到强的排列顺序是________________。
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式:________________________。
(3)如图K82所示的装置中,铁作________极,铜电极的电极反应式为________________。
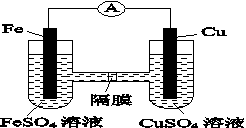
图K82
(4)已知铜与稀硫酸不反应,但铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示其原因:________________________________。
(5)氯化铝广泛用作有机合成和石油工业的催化剂。将铝土矿粉(主要成分为Al2O3)与焦炭混合后加热,并通入氯气,可得到氯化铝,同时生成CO。写出该反应的化学方程式:________________________________________。该反应中的氧化剂是________。
(6)某校兴趣小组为测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体。再将所得固体充分加热、灼烧,得到红棕色粉末1.60 g。通过计算确定此合金的组成为____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数, 在一定的温度和压强下,体积为V L的该气体所含有的分子数为X。则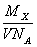 表示的是
表示的是
A.V L该气体的质量(以g为单位)
B.1 L该气体的质量(以g为单位)
C.1 mol该气体的体积(以L为单位)
D.1 L该气体中所含的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
已知图一表示的是可逆反应CO(g)+H2(g)  C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)  N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是 ( )。
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是 ( )。
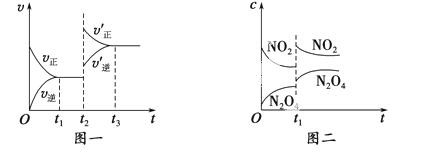
A.图一t2时改变的条件可能是升高了温度或增大了压强
B.若图一t2时改变的条件是增大压强,则反应的ΔH增大
C.图二t1时改变的条件可能是升高了温度或增大了压强
D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com