
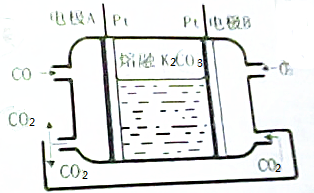
分析 (1)负极发生氧化反应,电极反应式为:CO-2e-+CO32-=2CO2;
(2)B极电极反应式为:O2+4e-+2CO2=2CO32-;而A极的电极反应式为:CO-2e-+CO32-=2CO2;
解答 解:(1)负极发生氧化反应,电极反应式为:CO-2e-+CO32-=2CO2,故答案为:CO-2e-+CO32-=2CO2;
(2)根据负极2CO+2CO32--4e-=4CO2,而正极反应为O2+4e-+2CO2═2CO32-,所以在转移4mol电子相同的情况下负极产生4mol的二氧化碳,而正极消耗2mol的二氧化碳,所以利用率为50%,故答案为:50%.
点评 本题考查电化学的相关知识,学生要掌握原电池的反应原理,以及在电子转移相等的情况下计算物质的转化率,比较容易.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 钢制品应接电源的正极 | |
| B. | 电镀时铝作阳极,阳极反应式为Al-3e-+7AlCl4-=4Al2Cl7- | |
| C. | 电解液中H+移向阴极,OH-移向阳极 | |
| D. | 每生成1mol铝,电解液中转移3mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

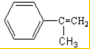
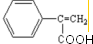
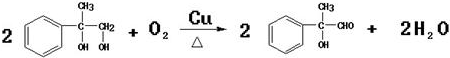 ;反应⑦n
;反应⑦n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$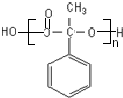 +(n-1)H2O
+(n-1)H2O查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A. | ②、⑧、⑨对应的简单离子半径依次增大 | |
| B. | ⑥的氯化物的熔点比⑦的氯化物熔点高 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①分别与③、④、⑤均可形成既含极性键又含非极性键的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2、NH3的水溶液虽都能够导电,但它们均属于非电解质 | |
| B. | 在浓硝酸中加入等体积浓硫酸后,立即加入铝片,铝片发生钝化 | |
| C. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 | |
| D. | 电解饱和食盐水的过程中,水的电离平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )
气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.则下列说法中正确的是( )| 待测气体 | 部分电极反应产物 |
| NO2 | NO |
| Cl2 | HCl |
| CO | CO2 |
| H2S | H2SO4 |
| A. | 上述气体检测时,敏感电极均作电池正极 | |
| B. | 检测Cl2时,敏感电极上发生还原反应 | |
| C. | 检测H2S时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 检测分别含H2S和CO体积分数相同的两份空气样本时,传感器上产生电流大小相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

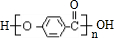
 .
.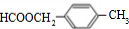 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室常用点滴板来完成部分实验,这样可以节约药品的用量,又便于观察实验现象.图中所示的实验描述的现象正确的是( )
实验室常用点滴板来完成部分实验,这样可以节约药品的用量,又便于观察实验现象.图中所示的实验描述的现象正确的是( )| A. | ①②③⑤ | B. | ①②⑥ | C. | ③⑤⑥ | D. | ②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com