
【题目】一定条件下,在水溶液中1molCl、ClO x (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
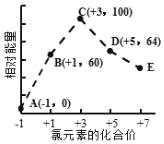
A.这些离子中结合H+能力最强的是E
B.A、B、C、D、E五种微粒中C最稳定
C.C→B+D的反应,反应物的总键能小于生成物的总键能
D.B→A+D是吸热反应
【答案】C
【解析】
A.对应酸的酸性越弱,则酸根离子结合氢离子的能力越强,高氯酸的酸性最强,因此ClO4 结合H+能力最弱,故A错误;
B.能量越低越稳定,则A、B、C、D、E五种微粒中A最稳定,C最不稳定,故B错误;
C.C→B+D为2ClO2-=ClO3-+ClO-,反应热△H =生成物的总能量-反应物的总能量=(64kJ/mol+60kJ/mol)-2×100kJ/mol=-76kJ/mol,则反应物的总键能小于生成物的总键能,故C正确;
D.B→A+D为3ClO-=ClO3-+2Cl-,反应热△H =(64kJ/mol+2×0kJ/mol)-3×60kJ/mol=-116kJ/mol,为放热反应,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、Cl-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是

A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中一定不含CO32-和SO42-,可能含有Cl-
C.溶液中n(Mg2+)=0.1mol
D.n(H+) :n(NH4+) : n(Al3+) : n(Mg2+)=2:4:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2一氨-3—氯苯甲酸是白色晶体,其制备流程如下:

已知: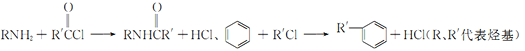
回答下列相关问题
(1)![]() 的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
(2)反应①中R代表的是_____________,反应②的反应类型为_____________。
(3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式_____________。
(4)A的结构简式为_____________,⑥的反应条件为_____________。
(5)符合下列条件的同分异构体的结构简式为_____________。
a.式量比![]() 大42的苯的同系物;
大42的苯的同系物;
b.与酸性KMnO4反应能生成二元羧酸
c.仅有3种等效氢
(6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。

分析产率提高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,近年来发现了一种新的星际分子,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子)。

下列对该物质的说法中正确的是
A. ①处的化学键表示碳碳双键 B. ②处的化学键表示碳碳单键
C. ③处的原子可能是氯原子或氟原子 D. 此星际分子属于烃类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)最近材料科学家发现了首例带结晶水的晶体在5K下呈现超导性。该晶体的化学式为Na0.35CoO2·1.3H2O(该晶体的摩尔质量为122g·mol-1),若用NA表示阿伏加德罗常数,则12.2g该晶体中含氧原子数为___,氢原子的物质的量为___mol。
(2)FeCl3溶液可以用来净水,用100mL2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数___(填“大于”“等于”或“小于”)0.2NA。
(3)在标准状况下,VL某气体(摩尔质量为Mg/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=___mol/L(用以上字母表示,且必须化简)。
(4)工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应:NaClO2+HCl→ClO2↑+NaCl+H2O。写出配平的化学方程式____。
(5)向100mL的FeBr2溶液中通入标准状况下Cl23.36L(已知还原性:Fe2+>Br-),反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为____mol/L。反应的离子方程式为____。
(6)若向盛有10mL1mol·L-1NH4Al(SO4)2溶液的烧杯中加20mL1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在现用周期表中氧族元素包括 ______________________(填元素名称)五种元素,其中Se的基态原子的电子排布式为______________________,元素X与Se同周期,X元素原子核外未成对电子数最多,X为______________________(填元素符号)。
(2)与氧同周期的相邻元素中,第一电离能有大到小的顺序______________________。
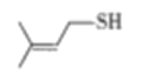
(3)臭鼬排放的臭气主要成分为3—MBT(3—甲基—2—丁烯硫醇,结构如图)。1mol3—MBT中含有σ键数目为____________(NA为阿佛加德罗常数的值)。沸点:3—MBT____________(CH3)2C==CHCH2OH(填“>”“<”或“=”),主要原因是________________________。
(4)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法正确的是__________(填序号)。
A.中心原子的价层电子对数不相等
B.都是极性分子
C.中心原子的核对电子数目不相等
D.都含有极性键
②SO3分子的空间构型为__________,与其互为等电子体的阴离子为__________(举一例)。
(5)单质Po是有__________键形成的晶体;若已知Po的摩尔质量为Mg·mol-1,原子半径为rpm,阿伏加德罗常数的值为NA,则钋晶体的密度的表达式为____________________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是

A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的操作正确的是
实验目的 | 实验操作 | |
A | 配制浓度为0.010 | 用托盘天平称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
B | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
C | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
D | 排水法收集KMnO4分解产生的O2 | 先移出导管,后熄灭酒精灯 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com