
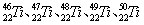 等。这些同位素原子的中子数不可能为
等。这些同位素原子的中子数不可能为| A.30 | B.28 | C.26 | D.24 |
科目:高中化学 来源:不详 题型:单选题
| A.在周期表里,主族元素所在的族序数等于原子核外电子数 |
| B.稀有气体元素的原子最外层电子数均为8 |
| C.在周期表里,元素所在的周期数等于原子核外电子层数 |
| D.元素的原子序数越大,其原子半径也越大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
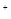 )/c(OH
)/c(OH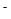 )
)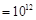 的溶液中;
的溶液中;| A.①③⑥ | B.①②④ | C.①②⑤⑦ | D.③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Y、Z、R的简单离子具有相同的电子层结构 |
| B.X2Y属于共价化合物,各原子均满足8电子稳定结构 |
| C.X、Z分别与Y均可形成A2B与A2B2型化合物,且A2B2均有较强的氧化性 |
| D.由X、Y、Z形成的化合物能与X、Y、R形成的化合物发生复分解反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | | A | B |
| C | D | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
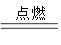 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 序 号 | 元素 | 结构及性质 |
| ① | A | 在地壳中的含量居于第三位,单质由电解法制取,其化学性质活泼,但在空气中能稳定存在;其离子半径在同周期中金属离子中最小。 |
| ② | B | B原子最外层电子数是内层电子数的1/5 |
| ③ | C | C单质分子中含化学键数最多,单质稳定,但其原子较活泼 |
| ④ | D | 通常情况下,D没有正化合价,A、B、C、E都能与D化合 |
| ⑤ | E | E在周期表中可以排在IA族,也有人提出排在ⅦA族、ⅣA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com