
【题目】(1)元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
①与氯元素同族的短周期元素的原子结构示意图为______。
②能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是____。
a. Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c. HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
③设计一个实验方案,证明氧化性Cl2>Br2:___________。
(2)铅是碳的同族元素,比碳多4个电子层。
①铅在元素周期表的位置为_______。
②PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___________。
【答案】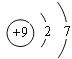 bc 向溴化钠溶液中通入氯气,溶液由无色变成橙色,Cl2 + 2NaBr=2NaCl + Br2 第六周期ⅣA族 PbO2+4HCl(浓)
bc 向溴化钠溶液中通入氯气,溶液由无色变成橙色,Cl2 + 2NaBr=2NaCl + Br2 第六周期ⅣA族 PbO2+4HCl(浓)![]() PbCl2+Cl2↑+2H2O
PbCl2+Cl2↑+2H2O
【解析】
(1)氯是卤族元素;同一主族元素,元素的非金属性越强,气态氢化物越稳定、单质的氧化性越强、最高价氧化物的水化物酸性越强、与氢气化合越容易;据此分析解答
(2)碳是第2周期第ⅣA族元素;PbO2与浓盐酸共热生成黄绿色气体,说明生成了氯气,结合氧化还原反应的规律分析解答。
(1)①与Cl同一主族是短周期元素是F元素,F原子核外有2个电子层、最外层7个电子,其原子结构示意图为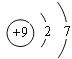 ,故答案为:
,故答案为: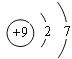 ;
;
②同一主族元素,元素的非金属性随着原子序数增大而减弱,元素的非金属性越强,其气态氢化物越稳定、单质的氧化性越强、最高价氧化物的水化物酸性越强、与氢气化合越容易,与物理性质无关,故答案为:bc;
③氧化性Cl2>Br2,说明氯气能够置换出溴化物溶液中的溴,因此可以通过:Cl2 + 2NaBr=2NaCl + Br2。设计实验验证,方法和现象为:向溴化钠溶液中通入氯气,溶液由无色变成橙色,故答案为:向溴化钠溶液中通入氯气,溶液由无色变成橙色,Cl2 + 2NaBr=2NaCl + Br2;
(2)①铅是碳的同族元素,比碳多4个电子层,则铅位于第六周期ⅣA族,故答案为:第六周期ⅣA族;
②PbO2与浓盐酸共热生成黄绿色气体,说明生成了氯气,根据氧化还原反应的规律,还应有PbCl2与水生成,反应的化学方程式为:PbO2+4HCl(浓)![]() PbCl2+Cl2↑+2H2O,故答案为:PbO2+4HCl(浓)
PbCl2+Cl2↑+2H2O,故答案为:PbO2+4HCl(浓)![]() PbCl2+Cl2↑+2H2O。
PbCl2+Cl2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】已知2FeSO4![]() Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
Fe2O3+SO2↑+SO3↑。下列有关操作、装置、原理及对现象的表述正确的是
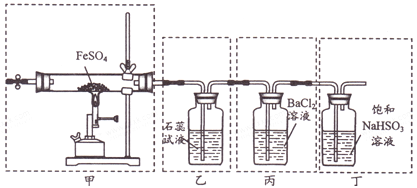
A. 用装置甲高温分解FeSO4,点燃酒精喷灯前应先向装置内通一段时间N2
B. 用装置乙可检验分解产生的SO2,现象是石蕊试液先变红后褪色
C. 用装置丙可检验分解产生的SO3,现象是产生白色沉淀
D. 用装置丁可吸收尾气,避免污染环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸D在有机合成和药物生产中有着广泛应用。用常见化工原料制备D,再由此制备有机物I的合成路线如下:
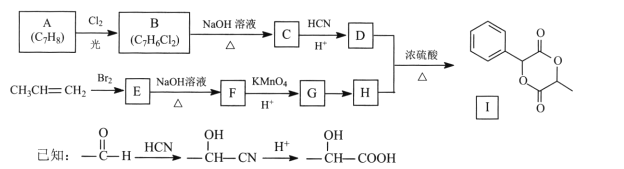
回答下列问题:
(l)C的名称是 ____,I的分子式为____。
(2)E→F的反应类型为____,G中官能团的名称为____ 。
(3) A→B的化学方程式为________。
(4)反应G→H的试剂及条件是________。
(5)写出符合下列条件的D的同分异构体:________。
①能发生银镜反应 ②与FeC13溶液显紫色 ③核磁共振氢谱峰面积之比1:2:2:3
(6)写出以溴乙烷为原料制备H的合成路线(其他试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.7475 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为 ( )
A.1∶1B.2∶1C.3∶1D.2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成巴比妥类镇静药物的中间体,一种以丙烯为原料合成H的路线如下:
![]()
已知:①A、B、C均可发生银镜反应。
②
请回答下列问题:
(1)A的化学名称是___,B中官能团的名称是___。
(2)由C生成D中反应i的化学方程式为___。
(3)E的结构简式为___,由E生成F的反应类型是___。
(4)与H互为同分异构体且与C互为同系物的有机物有___种,其中核磁共振氢谱有3组峰的结构简式为___(任写一种)。
(5)设计由乙烯、乙醇钠和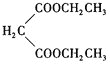 为原料制备2-乙基丁酸的合成路线
为原料制备2-乙基丁酸的合成路线![]() 无机试剂任选
无机试剂任选![]() ___。
___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素X、Y、Z、L、M,原子序数依次递增。X是原子半径最小的元素,Y的最高正价和最低负价的代数和为0,Z的气态氢化物和它的最高价氧化物对应的水化物能发生化合反应,L的最外层电子数是次外层的3倍,M是地壳中含量最高的金属元素。
回答下列问题:
(1)五种元素的原子半径从大到小的顺序是______(用元素符号表示)。
(2)X能分别与Y、Z、L形成具有相同电子数的化合物A、B、C。实验室制取B的化学方程式为______。
(3)Z的最高价氧化物对应水化物与M的最高价氧化物对应水化物反应的离子方程式为_______。
(4)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学拟用煤干馏的产物W为基本原料合成一系列化工产品,其流程如下(部分产物和条件省略):

己知部分信息如下:
①1mol芳香烃W含50mol电子;
②![]()
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
④K的分子式为C7H6O2,其核磁共振氢谱上有4个峰。
请回答下列问题:
(1)Y的名称为_______,反应Ⅳ的反应类型为__________。
(2)反应Ⅲ的化学方程式为___________
(3)J的分子式为_____________
(4)Z的结构简式为__________
(5)K的同分异构体M既能发生水解反应,又能发生银镜反应,M在氢氧化钠溶液中发生水解反应的化学方程式为_________
(6)L的同分异构体中,能和氯化铁溶液发生显色反应的有_______种。
(7)补充步骤Ⅶ流程:(仿照 )_______
)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业催化剂 K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备。请回答下列问题
(1)写出H2O2的电子式:___。
(2)配平该方程式:__FeC2O4·2H2O+__H2O2+__K2C2O4+__H2C2O4=__K3[Fe(C2O4)3]·3H2O
(3)制备过程中要防止草酸被H2O2氧化,请写出草酸被H2O2氧化的化学反应方程式___;
(4)配合物的稳定性可以用稳定常数K来衡量,如Cu2++4NH3=[Cu(NH3)4]2+,其稳定常数表达式为:K=![]() 。已知K[Fe(C2O4)3]3—=1020,K[Fe(SCN)3]=2
。已知K[Fe(C2O4)3]3—=1020,K[Fe(SCN)3]=2![]() 103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?___(填“是”或“否”)若选“否”,请设计检验铁元素的方案___。
103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素?___(填“是”或“否”)若选“否”,请设计检验铁元素的方案___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“![]() ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts核素符号是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com