
| A. | C5H12 | B. | C4H10 | C. | 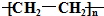 | D. | CHCl3 |
分析 纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;据此结合常见物质的组成成分以及同分异构体的概念判断解答.
解答 解:A.C5H12存在同分异构体,可表示CH3CH2CH2CH2CH3为正戊烷,去掉拿下1个碳原子作为支链: 为异戊烷,去掉2个碳原子作为支链:
为异戊烷,去掉2个碳原子作为支链: 为新戊烷,所以C5H12表示的不物质不一定是纯净物,故A错误;
为新戊烷,所以C5H12表示的不物质不一定是纯净物,故A错误;
B.C4H10 存在同分异构体,可表示正丁烷或者是异丁烷,所以C4H10 表示的不物质不一定是纯净物,故B错误;
C.乙烯发生加聚反应生成聚乙烯,由于聚合度n不同,故聚乙烯为混合物,故C错误;
D.化学式为CHCl3的物质只有一种结构是一氯甲烷结构,不存在同分异构体,一定是纯净物,故D正确;
故选D.
点评 本题考查了纯净物的判断,熟悉纯净物、混合物的概念,掌握同分异构体、同素异形体的判断是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 180Hf转化为185Hf是化学变化 | |
| B. | 二者的核外电子数分别为108、113 | |
| C. | 1mol 180Hf的中子数比1mol 185Hf少5NA | |
| D. | 在元素周期表中的位置不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 | |
| B. | 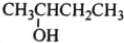 2-羟基丁烷 2-羟基丁烷 | |
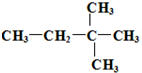
| C. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| D. | CH3CH(CH3)CH2COOH 3-甲基丁酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳,而氢气被认为是无碳无污染的清洁能源.
化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳,而氢气被认为是无碳无污染的清洁能源.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为24 | |
| B. | 最高价氧化物为SeO3,为酸性氧化物 | |
| C. | 原子半径比钙小 | |
| D. | 气态氢化物分子式为H2Se,性质不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 由另一种烃D通过加成反应而制得,则烃D的可能的是
由另一种烃D通过加成反应而制得,则烃D的可能的是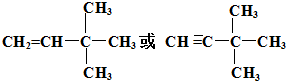 (任写一种可能的结构简式)
(任写一种可能的结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验中,温度计水银球应位于蒸馏烧瓶中液面以下 | |
| B. | 制备乙酸乙酯的实验中,导管末端要伸入饱和Na2CO3溶液液面下 | |
| C. | 分液操作中,待下层液体流出后,将上层液体从分液漏斗上口倒出 | |
| D. | 测定溶液pH时,可用pH试纸蘸取少量待测液并与标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
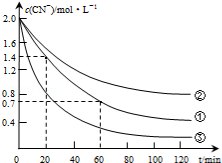 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中少量HCl气体:通过饱和NaHCO3溶液后再干燥气体 | |
| B. | 除去Na2CO3固体中少量NaHCO3:置于坩埚中加热 | |
| C. | 除去氧化铝中混有的少量二氧化硅,用足量的稀盐酸溶解后过滤 | |
| D. | 除去FeCl3酸性溶液中少量的FeCl2:通入稍过量的Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com