
| A. | F-、Cl-、Br-、I-的还原性逐渐减弱 | B. | NaOH、KOH、RbOH的碱性逐渐减弱 | ||
| C. | Li、Na、K、Rb、Cs的金属性逐渐减弱 | D. | HF、HCl、HBr、HI的稳定性逐渐减弱 |
分析 A.非金属性越强,对应离子的还原性越弱;
B.金属性越强,最高价氧化物对应的水化物碱性越强;
C.同主族元素自上而下,金属性逐渐增强;
D.元素非金属性越强,氢化物越稳定.
解答 解:A.因非金属性F>Cl>Br>I,所以还原性F-<Cl-<Br-<I-,故A错误;
B.因金属性Rb>K>Na,所以碱性NaOH<KOH<RbOH,故B错误;
C.同主族元素自上而下,金属性逐渐增强,所以Li、Na、K、Rb、Cs的金属性逐渐增强,故C错误;
D.因非金属性F>Cl>Br>I,所以稳定性HF>HCl>HBr>HI,故D正确;
故选D.
点评 本题考查元素周期律的递变规律,题目难度不大,掌握金属性和非金属性的判断依据是解题的关键,注意元素金属性和非金属性与单质或离子的还原性、氧化性的关系.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:多选题
| A. | 二者的pH仍然相等且均为5 | B. | 盐酸的pH大 | ||
| C. | 醋酸的pH大 | D. | 盐酸的pH为5,醋酸的pH在3~5之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
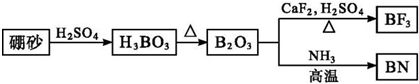
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①②③ | C. | ②⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
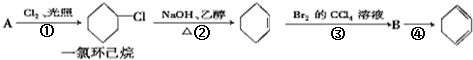
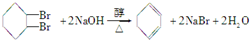 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
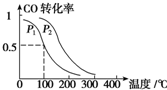 工业上CO 也用于合成甲醇:
工业上CO 也用于合成甲醇:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,正极发生的反应是Pb+SO42-+2e-═PbSO4 | |
| B. | 放电时,该电池的负极材料是铅板 | |
| C. | 放电时,电池中硫酸的浓度不断变小 | |
| D. | 放电时,每当消耗1 mol铅时转移电子2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com