
【题目】与氮不在同一周期的元素是 ______(选填编号)。
A. 碳 B. 氧 C. 氟 D. 氯
科目:高中化学 来源: 题型:
【题目】以海水为原料可以提取金属镁,图是某工厂从海水中提取镁的主要步骤.讨论以下相关问题 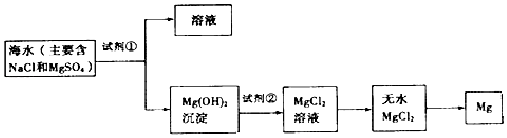
(1)在海水提镁的过程中如何实现对镁离子的富集 有三个学生提出自己的观点. 学生甲的观点:直接往海水中加入沉淀剂.
学生乙的观点:利用晒盐后的苦卤水,再加入沉淀剂.
学生丙的观点:高温加热蒸发海水后,再加入沉淀剂.
通过分析比较你认为学生的观点正确(填学生序号).
(2)为了使镁离子沉淀下来,充分利用当地的贝壳(主要成分为碳酸钙)资源获得沉淀剂,加入的试剂①是(填化学式).写出由贝壳制取试剂①的相关化学方程式:;
(3)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是(填标号字母)
A.蒸馏
B.分液
C.萃取
D.过滤
(4)加入的试剂②是(填化学式).工业过程中常常将蒸发结晶后的氯化镁水合物晶体再置于HCl气流中加热获得无水MgCl2 , 其目的是 .
(5)写出由无水MgCl2制取金属镁的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH相同的三种酸性溶液露置于空气中一段时间后,溶液的pH随时间的变化情况如图所示:则a、b、c三种溶液分别可能为( ) 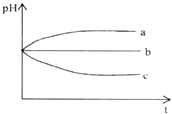
A.H2S溶液、稀H2SO4溶液、H2SO3溶液
B.氯水、稀HNO3溶液、NH4Cl溶液
C.H2SO3溶液、稀HCl溶液、氯水
D.H2S溶液、浓盐酸、H2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种微粒。已知:
①当A微粒失去3个电子后,其电子层结构与氖原子相同;
②当B微粒得到1个电子后其电子层结构与氩原子相同;
③C微粒带两个单位正电荷,核电荷数为12;
④D微粒有18个电子,当失去2个电子后显电中性;
⑤E微粒不带电,原子核中只有一个质子。
请回答:
(1)写出这五种微粒的符号:A_______,B_______,C_______,D______,E_______。
(2)B微粒的结构示意图________,D微粒的结构示意图_________。
(3)A的单质与EB溶液反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅﹣硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列9种物质:①氯气;②二氧化硫;③稀硫酸;④铁;⑤BaCl2固体;⑥氢氧化钾;⑦KNO3溶液;⑧酒精(C2H5OH);⑨氧化钙,请将上述物质按要求完成下列问题:
(1)用相应化学式填写下列空白:属于酸性氧化物的有_________________,属于碱性氧化物的有___________________,属于电解质的是________,属于非电解质的是__________。(用相应化学式填空)
(2)按要求完成下列方程式:
① 盐与酸反应_________________________________,
② 氧化物与碱溶液反应_________________________________,
③ 属于氧化还原反应的化合反应_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3)=6.0mol/L.用石墨作电极电解此溶液,当通电一段时间后,两极都收集到22.4L气体(标准状况),假设电解后溶液的体积仍为500mL.下列说法正确的是( )
A.原混合溶液中K+的物质的量浓度为1 mol/L
B.上述电解过程中共转移4mol电子
C.电解得到的Cu的物质的量为0.5mol
D.电解后溶液中H+的物质的量浓度为2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知: CO可将部分氮的氧化物还原为N2。
反应I :2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H=-746kJ.mol-1
N2(g)+2CO2(g) △H=-746kJ.mol-1
反应II :4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H=-1200kJ.mol-1
N2(g)+4CO2(g) △H=-1200kJ.mol-1
则反应NO2(g)+CO(g) ![]() CO2(g)+NO(g)的△H=______kJ/mol。
CO2(g)+NO(g)的△H=______kJ/mol。
(2)一定条件下,将NO2与CO以体积比1:2置于密闭容器中发生反应II,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.容器中气体密度保持不变
c.混合气体颜色保持不变 d.每消耗2molNO2的同时生成1molN2
(3)温度为T、容积为10L的恒容密闭容器中,充入1molCO和0.5 mol SO2发生反应:2CO(g)+SO2(g)![]() 2CO2(g)+S(g) 实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:
2CO2(g)+S(g) 实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:

①达到平衡状态时,SO2的转化率为__,该温度下反应的平衡常数K=______。
②其它条件保持不变,再向上述平衡体系中充入SO2(g).CO(g)、S(g)、CO2(g)各0.2mol,此时v(正)___v(逆) (填“>”“<”或“=”)。
(4)SCR法是工业上消除氦氧化物的常用方法,反应原理为4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H<0.在催化剂作用下,NO转化率与温度的关系如图所示:
4N2(g)+6H2O(g) △H<0.在催化剂作用下,NO转化率与温度的关系如图所示:

图中A点处NO的转化率_______(填“可能是”、“一定是 ”或“一定不是”)该温度下的平衡转化率;B点之后,NO转化率降低的原因可能是________。
A.平衡常数变大 B.副反应增多
C.催化剂活性降低 D.反应活化能增大
(5)2SO2(g)+O2(g) ![]() 2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。
2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com