
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)H2NCOONH4(s) ΔH=-272kJmol-1
第二步:H2NCOONH4(s)CO(NH2)2(s)+H2O(g) ΔH=+138kJmol-1
写出工业上以NH3、CO2为原料合成尿素和H2O(g)的热化学方程式:___。
(2)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g)2CO2(g)+S(s)。若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min内平均反应速率v(CO)=___,该温度下反应的化学平衡常数K=___。
(3)工业上可用NaClO碱性溶液或“亚硫酸盐法”吸收SO2。
①为了提高吸收效率,常用Ni2O3作为催化剂。催化过程如图1所示。

a.过程2的反应式为___。
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是___。
②室温下,(NH4)2SO3溶液中含硫组分物质的量分数随溶液pH的变化关系如图2所示,b点时溶液pH=7,则n(NH4+):n(SO32-)=___。

(4)用食盐水作电解液电解烟气脱氮的原理如图3所示,碱性条件下NO被阳极产生的Cl2氧化为NO3-,尾气经氢氧化钠溶液吸收后排入空气。碱性条件下NO被阳极产生的氧化性物质氧化为NO3-的离子方程式为___。

【答案】2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g) △H=-134kJmol-1 0.03mol/(Lmin) 11.25(mol/L)-1 2NiO2+ClO-=Cl-+Ni2O3+2O Ca2+和SO42-结合生成微溶的CaSO4有利于反应的进行 3:1 3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O
【解析】
(1)NH3、CO2合成尿素的反应是2NH3+CO2=CO(NH2)2+H2O,根据盖斯定律,推出结果;
(2)通过“三段式”进行计算化学反应速率和化学平衡平衡常数;
(3)①a.根据题中所给图示进行判断;
b.Ca2+能与SO42-结合成微溶于水的CaSO4;
②根据电荷守恒以及图像进行分析;
(4)根据装置图,阳极产物是Cl2,根据氧化还原反应的规律进行书写;
(1)已知:第一步:![]() ;
;
第二步:![]() ;
;
根据盖斯定律,由第一步![]() 第二步可得:
第二步可得:![]() ;
;
答案为:![]() ;
;
(2)由题知:设转化的![]() 为xmol,则有:
为xmol,则有: 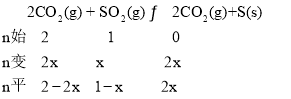
由![]() 的体积分数为
的体积分数为![]() 有:
有:![]() ,解之得:
,解之得:![]() ,
,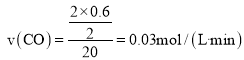 ;
;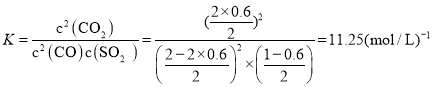 ;
;
答案为:![]() ;
;![]() ;
;
(3)①![]() 由图知,过程2的离子反应方程式为
由图知,过程2的离子反应方程式为![]() ;
;
答案为:![]() ;
;
![]() 也可用于脱硫,且脱硫效果比NaClO更好,原因是
也可用于脱硫,且脱硫效果比NaClO更好,原因是![]() 和
和![]() 结合生成微溶的
结合生成微溶的![]() 有利于反应的进行;
有利于反应的进行;
答案为:![]() 和
和![]() 结合生成微溶的
结合生成微溶的![]() 有利于反应的进行;
有利于反应的进行;
②![]() 点时溶液的
点时溶液的![]() ,根据电荷守恒可知
,根据电荷守恒可知![]() ,又根据图象曲线可知:
,又根据图象曲线可知:![]() ,
,![]() :
:![]() :
:![]() :1;
:1;
答案为:3:1;
(4)由图知:阳极产生的气体为![]() ,NO被
,NO被![]() 氧化为
氧化为![]() 反应的离子方程式
反应的离子方程式![]() ;故答案为:
;故答案为:![]() 。
。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、氮氧化物(NOx) 严重影响人们的生活和健康,化学工作者对氮氧化物的处理做了广泛而深人的研究。
I.利用甲烷还原NOX
①CH4(g)+4NO2(g)=4NO(g) +CO2(g)+2H2O(g) △H1=-574kJ/mol ;
②CH4 (g)+4NO(g)=2N2(g) +CO2(g)+2H2O(g) △H2=-1160 kJ/mol 。
(1)甲烷直接将NO2 还原为N2的热化学方程式为______________________________。
(2)在恒容(2L)密闭容器中充入1molCH4和2moINO2进行(1)中反应,CH4的平衡转化率φ。(CH4)与温度和压强的关系如图甲所示。
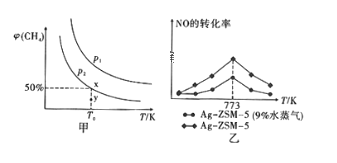
①若容器中的压强为p2,y 点; v 正________V逆(填“大于"“等于“或“小于”)。
②图中压强大小P1_______ P2
③X 点对应温度下反应的平衡常数K=______________ 。
II.某研究小组以Ag-ZSM-5为催化剂模拟汽车尾气的处理,实现NO和CO反应转化为无毒气体。同时利用反应放出的热量预热NO 和CO。实验测得NO的转化率随温度的变化如图乙所示。
(1)高于773K,NO的转化率降低的可能原因是_________________。
(2)为提高汽车尾气中NO的转化率,除了改变温度、压强外,还可以采取的措施有_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某酸H3A水溶液滴加KOH溶液,混合溶液中lgX随pH变化关系如图所示,图中X表示![]() 或
或![]() 或
或![]() 。下列说法正确的是( )
。下列说法正确的是( )
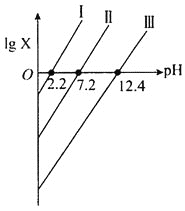
A.Ka2(H3A)的数量级为10-7
B.曲线Ⅰ表示pH与lg![]() 的变化关系
的变化关系
C.向H3A溶液中加入一定量的KOH溶液至pH=5时,![]() =100.6
=100.6
D.KH2A与K2HA等物质的量混合的溶液中:3c(K+)=2[c(H2A-)+c(HA2-)+c(A3-)+c(H3A)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测。某工厂对制铬工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸液中金属离子主要是Cr3+,其次是Fe3+, Fe2+, Al3+, Ca2+, Mg2+)

常温下部分阳离子的氢氧化物形成沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是_____________________________(至少一条)
(2)调pH=4.0是为了除去______________________(填Fe3+, Al3+, Ca2+, Mg2+)
(3)钠离子交换树脂的原理为Mn++ n NaR → MRn+nNa+,被交换的杂质离子是___________________________(填Fe3+, Al3+, Ca2+, Mg2+)
(4)试配平下列氧化还原反应方程式:
____Na2Cr2O7+__SO2+____H2O =____Cr(OH)(H2O)5SO4+___Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据核外电子的排布特点推断元素的性质:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其基态原子的电子排布图为_____,在周期表中位于___区。
(2) B元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子,B的基态原子的价层电子排布式为_______。
(3)请利用电子排布的相关知识稳定性:Fe3+______Fe2+(填>或< ),原因___________,第一电离能:Mg____Al(填>或< )原因__________。
(4) 有以下物质:①H2 ②N2 ③CO2 ④N2H4⑤H2O2 ⑥HCN(H—C≡N);只有σ键的是______;既有σ键又有π键的是__________;含有由两个原子的s轨道重叠形成的σ键的是_____;含有由一个原子的s轨道与另一个原子的p轨道重叠形成的σ键的是______;
(5) 通过 (3)的解答,请归纳基态原子核外电子排布除了符合构造原理外,泡利原理、洪特规则外,还有哪些结构稳定__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中存在许多平衡,如化学平衡、电离平衡、水解平衡、溶解平衡等等,对应的有化学平衡常数、电离平衡常数等。按要求回答下列问题:
(1)反应H2(g)+I2(g)2HI(g)的平衡常数为K1;反应HI(g)![]() H2(g)+
H2(g)+![]() I2(g)的平衡常数为K2,则K1、K2之间的关系式为___(平衡常数为同温度下的测定值)
I2(g)的平衡常数为K2,则K1、K2之间的关系式为___(平衡常数为同温度下的测定值)
(2)汽车净化原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是___。
2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是___。

(3)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-H++B2-。在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是___。
A.c(B2-)+c(HB-)=0.1mol/L B.c(B2-)+c(HB-)+c(H2B)=![]() c(Na+)
c(Na+)
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(4)下表为几种酸的电离平衡常数
CH3COOH | H2CO3 | H2S |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
则pH相同的CH3COONa、Na2CO3、NaHS溶液物质的量浓度由大到小的顺序为___,少量CO2与NaHS反应的离子方程式为___。
(5)25℃时,向0.01molL-1的MgCl2溶液中,逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的pH为___;当Mg2+完全沉淀时,溶液的pH为___(忽略溶液体积变化,已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,已知lg2.4=0.4,lg7.7=0.9。
(6)已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应:Fe(OH)3+3H+Fe3++3H2O的平衡常数K=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )
A.装置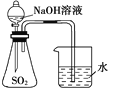 可用于证明
可用于证明![]() 与NaOH溶液发生了反应
与NaOH溶液发生了反应
B.装置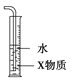 中X为
中X为![]() ,可用于吸收氨或氯化氢
,可用于吸收氨或氯化氢
C.装置 可用于实验室从食盐水中提取氯化钠
可用于实验室从食盐水中提取氯化钠
D.装置 可用于证明浓硫酸与乙醇共热生成乙烯
可用于证明浓硫酸与乙醇共热生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为285.5 kJmol-1,则水电解的热化学方程式为:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g) ![]() H=+285.8kJmol-1
H=+285.8kJmol-1
B.1mol甲烷完全燃烧生成CO2 (g)和H2O(l)时放出890kJ热量,它的热化学方程式为 1/2CH4(g)+O2(g) ![]() 1/2CO2(g)+H2O(l)
1/2CO2(g)+H2O(l) ![]() H=-445kJmol-1
H=-445kJmol-1
C.已知2C(s)+O2(g) ![]() 2CO(g)
2CO(g) ![]() H=-221kJmol-1,则C的燃烧热为110.5 kJmol-1
H=-221kJmol-1,则C的燃烧热为110.5 kJmol-1
D.HF与NaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) ![]() H=-57.3kJmol-1
H=-57.3kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(![]() ),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
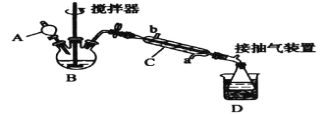
①在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;
②不断搅拌并控制装置B中混合液的温度为20~30℃至反应结束;
③接入仪器C和抽气泵,在锥形瓶中收集得到产品。
回答下列问题:
(1)仪器C的名称是____,仪器C中冷水流入口是____(填“a”或“b”)。
(2)为更好地控制反应温度,应采用的加热方法是_____。
(3)生成过氧乙酸的化学方程式为____。
(4)实验测得产物过氧乙酸的百分含量随反应物比例和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是_____,最佳反应时间约_____。
反应物比例CH3COOH/H2O2 | 反应时间 | ||||
0.5h | 1h | 3h | 5h | 7h | |
2:1 | 7.38% | 8.46% | 9.42% | 11.26% | 13.48% |
1:1 | 0.56% | 12.92% | 13.54% | 20.72% | 20.80% |
1:2 | 6.14% | 7.10% | 7.96% | 10.38% | 12.36% |
(5)产品中过氧乙酸浓度的测定:取2.00mL过氧乙酸产品试样,加水稀释成100mL;从中取出5.00mL,逐滴滴加酸性KMnO4溶液至溶液恰好呈粉红色,以除去残余的H2O2;再加入稍过量的KI溶液,发生反应CH3COOOH+2I-+2H+=I2+CH3COOH+H2O;反应完全后,滴入几滴淀粉溶液,用0.1000mol·L-1的Na2S2O3标准液滴定至终点(反应式为2S2O32-+I2=S4O62-+2I-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com