
| A. | Na+、SO42-、Cl-、NO3- | B. | K+、Fe3+、Cl-、SCN- | ||
| C. | H+、Mg2+、SO42-、NO3- | D. | Al3+、K+、HS-、Na+ |
分析 加入Al粉有H2放出,为非氧化性酸或强碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能结合生成络离子,不能相互促进水解等,则离子大量共存,以此来解答.
解答 解:A.碱溶液中该组离子之间不反应,可大量共存,故A选;
B.Fe3+、SCN-结合生成络离子,不能共存,故B不选;
C.碱性溶液不能大量存在H+、Mg2+,酸溶液中Al、H+、NO3-发生氧化还原反应不生成氢气,故C不选;
D.Al3+、HS-相互促进水解,不能共存,故D不选;
故选A.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、水解反应、氧化还原反应的判断,题目难度不大.


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | Y的转化率为60% | B. | 反应速率v(Y)=0.3 mol/(L•min) | ||
| C. | a的值为2 | D. | 平衡时X的浓度为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
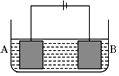 按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )
按如图所示的装置进行电解实验.A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量).通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为( )| A. | 4:1 | B. | 3:1 | C. | 2:1 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅原子和钠原子 | B. | 铜原子和氦原子 | C. | 碳原子和铝原子 | D. | 氧原子和碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
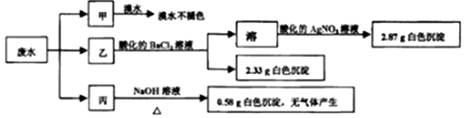
| A. | 废水可能含有Na+、K+、Fe3+ | |
| B. | 可能存在的离子用焰色反应进一步检验确认 | |
| C. | 废水一定含有Cl-、SO42-和Mg2+,且c(Cl-)=0.2mol•L-1 | |
| D. | 废水一定不含 SO32-、Cl-、NH4+、Na+、K+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(CO2) | n(H2) | n(CH3OH(g) | n(H2O(g) | |
| 0 | 1.00mol | 3.25mol | 0.00 | 0.00 |
| 5min | 0.50mol | 0.50mol | ||
| 10min | 0.25mol | 0.75mol | ||
| 15min | 0.25mol | n1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉花、羊毛、丝绸的主要成分均为蛋白质 | |
| B. | 丙烷中的3个碳原子一定在同一平面上 | |
| C. | 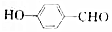 中含有的官能团有3种 中含有的官能团有3种 | |
| D. | 乙烯使溴水和酸性KMnO4溶液褪色的原理相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com