
【题目】1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是
A. 元素周期表含元素最多的族是第ⅢB族
B. 元素周期表有18个族
C. 第1 A族的元素全部是金属元素
D. 短周期是指第一、二、三、四周期
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】“瘦肉精”是一种能减少脂肪增加瘦肉的药品,有很危险的副作用,轻则导致心律不齐,重则导致心脏病。下列关于两种常见瘦肉精的说法不正确的是( )
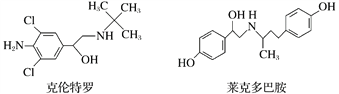
A. 克伦特罗分子的分子式为C12H18ON2Cl2
B. 克伦特罗能发生加成、氧化、消去等反应
C. 克伦特罗和莱克多巴胺可以用FeCl3溶液鉴别
D. 莱克多巴胺与足量NaOH溶液反应,生成物的化学式为C18H20NO3Na3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 常温常压下,16g CH4含有CH4分子数为NA
B. 常温常压下,22.4L CO2含有CO2分子数为NA
C. 1mol Na燃烧生成Na2O2失去的电子数为2NA
D. 0.5mol·L-1 的CuCl2溶液中含Cl-数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种。若将甲溶液滴入乙溶液中,无明显现象发生,甲溶液滴入丙溶液时,发现有白色沉淀生成,继续滴加则沉淀消失。据此可推断丁物质是
A. Al2(SO4)3 B. FeSO4
C. NaOH D. BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室中常用加热分解氯酸钾制取氧气,写出反应的化学方程式,并用双线桥法仅标出电子转移情况___________________________________________________________。
(2))实验室制取Cl2的反应方程式之一为:
___ KMnO4 + ____ HCl —— ____KCl +____MnCl2 + ___ C12↑ + ___ H2O
请①配平方程式;②用单线桥法仅标出电子转移情况_________;
③浓盐酸表现出来的性质是:_______________;
④当有5摩HCl被氧化时,求产生的氯气在标准状况下的体积:___________。
(3)KClO3+6HCl===KCl+3Cl2↑+3H2O写出氧化产物还原产物物质的量的比为_________,当氧化产物比还原产物多71克时,参加反应的还原剂为________摩。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是
A.配体为水分子,外界为 Br-
B.中心离子的配位数为6
C.中心原子采取sp3杂化
D.中心离子的化合价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银是一种美丽的银白色的金属,其导电性和导热性非常好,银及其合金广泛应用于电子电器材料、感光材料、化工材料等方面。
(1)银与铜同族,铜元素在周期表中的位置是__________。基态铜原子的电子排布式是____________________。
(2)Ag+能与NH3、![]() 、CN等形成配位数为2的配合物。
、CN等形成配位数为2的配合物。
①C、N、O三种元素的第一电离能从大到小的顺序为__________。
②利用AgNO3和氨水可配制[Ag(NH3)2]OH溶液,在[Ag(NH3)2]OH中存在的化学键的类型有__________(填字母)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③![]() 中N原子的杂化轨道类型是__________,空间构型为__________。写出一种与
中N原子的杂化轨道类型是__________,空间构型为__________。写出一种与![]() 、SO2互为等电子体的短周期元素单质分子的化学式__________。
、SO2互为等电子体的短周期元素单质分子的化学式__________。
(3)银晶体的晶胞如图所示,为面心立方最密堆积,则银原子的配位数为__________。
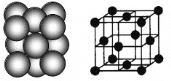
晶体空间利用率是指构成晶体的微粒在整个晶体空间中所占的体积分数,即空间利用率=![]() ×100%。则银晶体的空间利用率为__________(保留2位有效数字,
×100%。则银晶体的空间利用率为__________(保留2位有效数字,![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中少量杂质的方法正确的是( )
A.除去FeCl2溶液中混有的FeCl3加入过量铁粉,过滤
B.除去NO2中混有的NO:用水洗气
C.除去SO2中混有的HCl:用饱和亚硫酸钠溶液洗气
D.除去Cu粉中混有的Cu0:加适量稀硝酸后,过滤、洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确有( )个
①常温常压下,28gC2H4和C4H8的混合物中一定含有6NA个原子
②0℃,101Kpa,22.4LCl2通入足量的NaOH溶液充分反应,有2NA个电子转移
③常温下,pH=12的氢氧化钠溶液中OH-数目为0.01NA
④1L1.0mol/LFeCl3溶液全部水解制备氢氧化铁胶体,所得氢氧化铁胶粒数目为NA
⑤T℃时,1 L pH=6纯水中,含10-6NA个H+
⑥常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA
⑦lmolSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
⑧用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA
⑨标准状况下,22.4LHF气体中含有NA个气体分子
A. 0 B. 1 C. 2 D. 3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com