
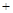 2H2(g)
2H2(g)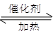 CH3OH(g)
CH3OH(g)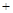 Q
Q| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
 ����������Ҫ���COת���ʣ��ɲ�ȡ�Ĵ�ʩ
����������Ҫ���COת���ʣ��ɲ�ȡ�Ĵ�ʩ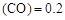 mol��L������CH3OH��ʾ�ķ�Ӧ����v
mol��L������CH3OH��ʾ�ķ�Ӧ����v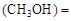 mol /(L��min)��
mol /(L��min)�� CO2(g)
CO2(g)  2CO(g) ƽ�ⳣ��K1
2CO(g) ƽ�ⳣ��K1 H2O(g)
H2O(g)  CO(g)
CO(g)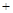 H2(g) ƽ�ⳣ��K2
H2(g) ƽ�ⳣ��K2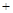 H2O(g)
H2O(g)  H2(g)
H2(g)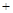 CO2(g) ƽ�ⳣ��K3
CO2(g) ƽ�ⳣ��K3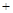 2H2(g)
2H2(g)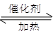 CH3OH(g)
CH3OH(g)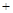 Q
Q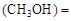 0.8/10=0.08(mol��L��min)
0.8/10=0.08(mol��L��min)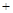 CO2(g)
CO2(g)  2CO(g) ƽ�ⳣ��K1
2CO(g) ƽ�ⳣ��K1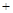 H2O(g)
H2O(g)  CO(g)
CO(g)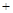 H2(g) ƽ�ⳣ��K2
H2(g) ƽ�ⳣ��K2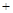 H2O(g)
H2O(g)  H2(g)
H2(g)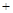 CO2(g) ƽ�ⳣ��K3
CO2(g) ƽ�ⳣ��K3


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 CO2(g)+H2(g)����֪CO��g����H2O(g)����ʼŨ�Ⱦ�Ϊ2mol��L-1�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K=1�����жϣ�
CO2(g)+H2(g)����֪CO��g����H2O(g)����ʼŨ�Ⱦ�Ϊ2mol��L-1�����ⶨ�÷�Ӧ�ڸ��¶��µ�ƽ�ⳣ��K=1�����жϣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3(g) ��H��0 ����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺
2NH3(g) ��H��0 ����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ��ʾ����ش��������⣺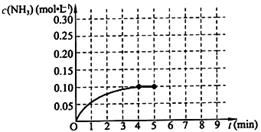
| A��3v����H2����2v����NH3�� |
| B�������������ƽ����Է���������ʱ����仯 |
| C��������������ܶȲ���ʱ����仯 |
| D������������ķ�����������ʱ����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3��g�� ��H=��92.4 kJ/mol
2NH3��g�� ��H=��92.4 kJ/mol| A��NH3���ɵ�������NH3�ֽ��������� |
B���������ķ�Ӧ���� v����NH3��=v����H2�� v����NH3��=v����H2�� |
| C�������ڵ��ܶȲ��ٱ仯 |
| D����λʱ��������a mol N2��ͬʱ����2a mol NH3 |
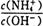 ֵ��_____(����� ����С�� ���䡱)��
ֵ��_____(����� ����С�� ���䡱)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Cu2+ (aq) + 2Ag (s)��Ƴ�ԭ��أ�ijһʱ�̵ĵ����������ƣ�G��ָ��ƫת������ͼ��ʾ���й�������ȷ����
Cu2+ (aq) + 2Ag (s)��Ƴ�ԭ��أ�ijһʱ�̵ĵ����������ƣ�G��ָ��ƫת������ͼ��ʾ���й�������ȷ����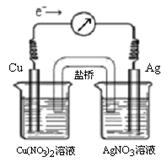
| A��KNO3�����е�K+����Cu(NO3)2��Һ |
| B����������ָ��Ϊ0ʱ���÷�Ӧ��ƽ�⣬ƽ�ⳣ��K=0 |
| C������ʱ��AgNO3��Һ�м���NaCl���壬����NaCl�������ӣ�������ָ������ƫת���ȼ�С��ָ��ָ��0������ƫת |
| D������ʱ��Cu(NO3)2��Һ�м���NaOH���壬����NaOH�������ӵ�����ָ������ƫת���ȼ�С��ָ��ָ��0������ƫת |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)���й�����ͼ��˵���IJ���ȷ����
2C(g)���й�����ͼ��˵���IJ���ȷ����
| A������ͼa���ж�����ӦΪ���ȷ�Ӧ |
| B����ͼb�У����߿ɱ�ʾʹ���˴��� |
| C��������Ӧ�ġ�H��0��ͼc�ɱ�ʾ�����¶�ʹƽ�����淴Ӧ�����ƶ� |
| D����ͼd�л�������ƽ����Է����������¶ȵı仯���������֪����Ӧ�ġ�H>0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
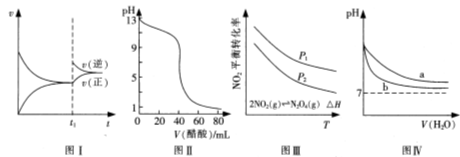
A��ͼI�ɱ�ʾN2+3H2 2NH3������ʱ��ͼ��t1ʱ�̸ı�������������¶� 2NH3������ʱ��ͼ��t1ʱ�̸ı�������������¶� |
| B��ͼ��ɱ�ʾ��0.1 000 mol/L����ζ�40.00 mL0.1000 mol/LNaOH��Һ�õ��ĵζ����� |
| C��ͼ��ɱ�ʾNO2ƽ��ת�������¶ȡ�ѹǿ�ı仯��ϵ����ͼ��֪����H<0��P1<P2 |
| D��ͼ���ɱ�ʾpH��ͬ��NaOH��Һ�백ˮϡ���̵�pH�仯����������a��Ӧ��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H2+CO2���������ڼ���1molCO��1mol H2O��g��ʱ������2/3mol CO2���ͨ���H2O��g����Ϊ4molʱ�������������£�����CO2�����ʵ���Ϊ
H2+CO2���������ڼ���1molCO��1mol H2O��g��ʱ������2/3mol CO2���ͨ���H2O��g����Ϊ4molʱ�������������£�����CO2�����ʵ���Ϊ| A��0��5mol | B��0��6mol | C��0��9mol | D��2��5mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 3C(g) �� D(s)����Ӧ�ﵽƽ��ʱC��Ũ��Ϊ1.2 mol/L.
3C(g) �� D(s)����Ӧ�ﵽƽ��ʱC��Ũ��Ϊ1.2 mol/L.�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com