
| A. | 晶体中含有受热不分解的杂质 | |
| B. | 加热过程中有少量晶体爆溅损失 | |
| C. | 加热后未放入干燥器中冷却 | |
| D. | 加热时未进行搅拌,看到固体边缘变白就停止加热 |
分析 在硫酸铜晶体(CuSO4•n H2O)结晶水含量测定中,加热前后质量的减少量即是失去结晶水的质量,当晶体中含有受热不分解的杂质、加热后未放入干燥器中冷却、加热时未进行搅拌,看到固体边缘变白就停止加热等都会导致n偏小;加热过程中有少量晶体爆溅损失时,测定的结晶水的质量偏高,测定结果偏高,据此进行解答.
解答 解:A.晶体中含有受热不分解的杂质,导致测定的结晶水质量偏低,测定的n偏小,故A错误;
B.加热过程中晶体爆溅,而造成加热前后固体的质量差偏大,使测量结果偏高,故B正确;
C.加热后未放入干燥器中冷却,导致测定的结晶水质量偏低,测定的n偏小,故C错误;
D.加热时未进行搅拌,看到固体边缘变白就停止加热,晶体未完全变白,导致晶体分解不完全,固体的质量差偏小,使测量结果偏小,故D错误;
故选B.
点评 本题考查硫酸铜晶体中结晶水的测定,题目难度不大,把握实验操作时的注意事项,分析误差时从导致加热前后的质量差进行判断,试题培养了学生的化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | 只有①④ | C. | 只有②③ | D. | 只有③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag得到电子 | B. | X为AgS | ||
| C. | O2被还原 | D. | 每生成1 mo1X转移电子数4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
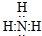 ,氯化铵
,氯化铵 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
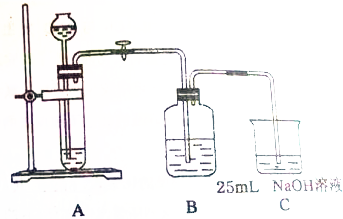 某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤:
某同学拟用50mlNaOH溶液吸收CO2气体制备Na2CO3溶液.为了防止通入的CO2气体过量生产NaHCO3,他设计了如下实验步骤:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
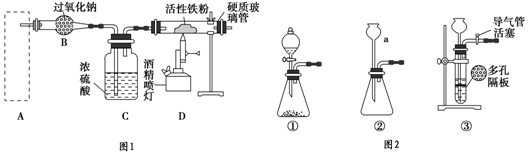
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,c(H+)=1×10-12mol•L-1的溶液中:A13+、Fe3+、SO42-、Cl- | |
| B. | pH=0的溶液中:Fe2+、Ba2+、NO3-、Cl- | |
| C. | 常温下,水电离的c(H+)为1×10-12mol•L-1的溶液中:Na+、NH4+、HCO3-、NO3- | |
| D. | 能使酚酞试液变红色的溶液中:Na+、K+、SiO32-、S2O32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com