
【题目】高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图甲是高铁电池的实验装置:已知放电后,两极得到铁的相同价态的化合物。
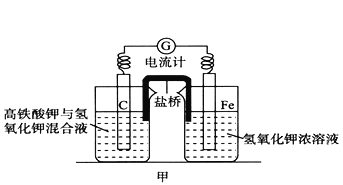
(1)该电池放电时正极发生的电极反应是___________。
(2)若该电池属于二次电池,则充电时阴极反应的电极反应式为___________ 。
(3)已知盐桥中含有饱和KCl溶液,放电时,盐桥的作用是___________。此盐桥中阴离子的运行方向是___________;若用某种高分子材料制成隔膜代替盐桥,该隔膜允许通过的离子是___________。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为___________mol·L1,此时溶液中c(CrO42-)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
【答案】 FeO42-+4H2O+3e- =Fe(OH)3↓+5OH- Fe(OH)3+3e- =Fe+3OH- 形成闭合回路 左池到右池 K+和H+ 2.0×10-5 5.0×10-3
【解析】(1)FeO42-在正极得电子生成Fe3+,该电池放电时正极发生的电极反应为:FeO42-+4H2O+3e- =Fe(OH)3↓+5OH-;(2)充电时Fe(OH)3在阴极得电子生成Fe,其电极反应式为:Fe(OH)3+3e- =Fe+3OH-;(3)盐桥中含有饱和KCl溶液,盐桥能够使装置形成闭合回路,并保持两边溶液呈电中性。此盐桥中阴离子的运行方向是向负极移动,即从左池到右池;该隔膜应该是阳离子交换膜,允许通过的离子是K+和H+。(4)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10-10,计算得到c(Ag+)=2.0×10-10/1.0×10-5= 2.0×10-5mol/L,此时溶液中c(CrO42-)= 2.0×10-12/(2.0×10-5)2= =5.0×10-3mol/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图所示的实验装置可用来测定含两种元素的某种气体X的分子式: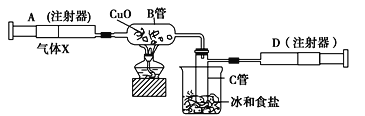
在注射器A中装有240毫升气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到下面的实验结果:
①实验前B管重20.32克,实验后B管重20.00克;②B管中的黑色粉末变成红色粉末;
③在C管中收集到的无色液体是水;④在注射器D中收集到的气体是氮气。
请回答下列问题:
(1)X气体是由________和________元素组成的。
(2)若240毫升X气体完全反应后,收集到的氮气质量是0.28克。根据实验时温度和压强计算1摩尔X气体的体积是24 000毫升,则X的摩尔质量是___________克/摩尔。
(3)通过计算,确定X的分子式为____________。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应) ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2FeCl3+Cu=2FeCl2+CuCl2。
(1)请用双线桥法标出电子转移的方向和数目____________________。
(2)当有0.3 mol电子发生转移时,发生反应的Cu的质量为_____________。
(3)请将以上反应改写为离子方程式____________________。
(4)配平下列方程式:__FeCl2+___H2O2+___HC1=___FeCl3+___H2O。
(5)下列变化中,需要加入还原剂的是__________________
A.浓H2SO4→SO2 B.H2S→S C.HCO3-→CO2 D.Fe2+→Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用乙酸和乙醇制备乙酸乙酯,为除去所得的乙酸乙酯中残留的乙酸,应选用的试剂是( )
A.饱和碳酸钠溶液B.饱和 NaOH溶液C.饱和食盐水D.浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯乙烯的结构为![]() 。有关该物质的下列说法正确的是
。有关该物质的下列说法正确的是
A. 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物有6种
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去 中的苯乙烯可以通入等量氢气反应
中的苯乙烯可以通入等量氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个体积为1L的密闭容器中,充入2molA和1molB,发生如下反应:2A(g) + B(g)![]() xC(g) ,平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是 ( )
xC(g) ,平衡后,C的体积分数为W%,若维持容器容积和温度不变,0.6molA 、0.3molB 和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是 ( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质属于电解质的是______;能导电的是_____;属于弱电解质的是______(均填写序号)。
①醋酸溶液②乙醇③胆矾④熔融氯化钠⑤二氧化硫⑥氨水⑦硫酸钡⑧蔗糖⑨氢氧化铁⑩浓盐酸
(2)Cl2通入一定浓度NaOH溶液后生成了三种含氯化合物,其中n(NaClO):n(NaClO3)= 5:1,写出Cl2与NaOH溶液反应的化学方程式并用双线桥表示出电子转移的方向和数目:_________。
(3)标准状况下4.48LCO2溶于100mL3.0mol/LNaOH溶液,所得产物成分是_____,物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的作用,下列叙述正确的是
A. 氧化铝的熔点很低,不能用于制作耐高温材料
B. 光化学烟雾与氮氧化合物有关
C. 无水乙醇用作医用消毒剂效果更好
D. Na、S、C分别在氧气中燃烧均可得到两种不同的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 苯和苯乙烯是同系物
B. 乙醇和乙醚是同分异构体
C. 显酸性的有机化合物一定是羧酸
D. 纤维素、蛋白质、天然橡胶都是高分子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com