
分析 (1)3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4中,只有O元素的化合价降低,利用化合价计算转移电子;
(2)氯化铁与铜发生氧化还原反应生成氯化铜和氯化亚铁;从腐蚀废液中回收金属铜,应加入过量的铁粉,使铁与铜离子反应置换铜,然后用过量的盐酸溶解剩余的铁粉;
(3)酸性废水中抑制铁离子的水解.
解答 解:(1)3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4中,有3mol FeS2参加反应,8mol氧气参加反应,只有O元素的化合价降低,则转移电子为8mol×2×[0-(-2)]=32mol,
故答案为:32;
(2)氯化铁与铜发生氧化还原反应生成氯化铜和氯化亚铁,离子方程式:2Fe3++Cu=2Fe2++Cu2+;
从腐蚀废液中回收金属铜,应加入过量的铁粉,使铁与铜离子反应置换铜,然后用过量的盐酸溶解剩余的铁粉;
故答案为:2Fe3++Cu=2Fe2++Cu2+;铁粉,稀盐酸;
(3)因酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体,则硫酸铁并不能使酸性废水中的悬浮物沉降除去,
故答案为:酸性废水抑制三价铁离子水解,不易形成胶体而净水.
点评 本题考查了Fe单质及其化合物的性质、氧化还原反应及离子反应方程式的书写,把握反应中元素的化合价变化及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两极共生成三种气体 | |
| B. | 阴极反应式为:Ag++e-═Ag | |
| C. | 阳极始终发生“2Cl--2e-═Cl2↑”的反应 | |
| D. | 向电解后的溶液中通入适量的HCl气体可使溶液复原到电解前的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S | B. | S | C. | Fe2+ | D. | Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中的少量溴单质(NaOH溶液、分液) | |
| B. | 溴乙烷中的乙酸(NaOH溶液、蒸馏) | |
| C. | 乙醇中的水(生石灰、过滤) | |
| D. | 苯中含有少量苯酚(溴水、过滤) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
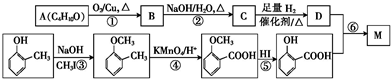
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
| 次氯酸 | 磷酸 | 硫酸 | 高氧酸 | |
| 含氧酸 | Cl-OH |  |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH═Na2HPO3+2H2O. .铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度9.0 g/cm3.
.铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度9.0 g/cm3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期ⅣA族,p区 | B. | 第四周期ⅡA族,s区 | ||
| C. | 第四周期Ⅷ族,d区 | D. | 第四周期ⅡB族,s区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com