
【题目】下列判断不正确的是
①若NaA、NaB溶液的pH分别为9和8,则酸性一定是![]() ;
;
②![]() 溶液蒸干得
溶液蒸干得![]() 固体,
固体,![]() 溶液蒸干得
溶液蒸干得![]() 固体;
固体;
③![]() 水解产生
水解产生![]() 和
和![]() ,向水解液中加入少量冰醋酸会因其中和
,向水解液中加入少量冰醋酸会因其中和![]() 而使水解平衡右移;
而使水解平衡右移;
④中和pH和体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同;
⑤因![]() ,为抑制水解,配制
,为抑制水解,配制![]() 溶液时需将
溶液时需将![]() 溶解在稀
溶解在稀![]() 中.
中.
A.只有①②B.只有②③⑤C.只有①②③⑤D.全部
【答案】D
【解析】
①没有给出NaA、NaB溶液的浓度,所以不能根据NaA、NaB溶液的pH大小判断HA和HB的酸性强弱,故错误;
②![]() 加热促进水解生成
加热促进水解生成![]() 和HCl,HCl易挥发,促进平衡正移,所以
和HCl,HCl易挥发,促进平衡正移,所以![]() 溶液蒸干得
溶液蒸干得![]() 固体;
固体;![]() 溶液加热促进水解,碳酸钠水解生成碳酸氢钠和氢氧化钠,都是难挥发物质,当蒸发水时,二者浓度变大又重新生成
溶液加热促进水解,碳酸钠水解生成碳酸氢钠和氢氧化钠,都是难挥发物质,当蒸发水时,二者浓度变大又重新生成![]() ,所以蒸干得到的仍是碳酸钠固体,故错误;
,所以蒸干得到的仍是碳酸钠固体,故错误;
③![]() 溶液存在以下平衡:
溶液存在以下平衡:![]() ,加入少量冰醋酸,
,加入少量冰醋酸,![]() 浓度增大,使水解平衡逆移,故错误;
浓度增大,使水解平衡逆移,故错误;
④![]() 相同的盐酸和醋酸溶液中氢离子浓度相同,由于醋酸是弱酸,部分电离,所以醋酸的浓度大,而且盐酸和醋酸的体积也相同,醋酸的物质的量多,所以醋酸中和的氢氧化钠多,故错误;
相同的盐酸和醋酸溶液中氢离子浓度相同,由于醋酸是弱酸,部分电离,所以醋酸的浓度大,而且盐酸和醋酸的体积也相同,醋酸的物质的量多,所以醋酸中和的氢氧化钠多,故错误;
⑤配制![]() 溶液时,加稀
溶液时,加稀![]() ,会引入杂质,所以配制
,会引入杂质,所以配制![]() 溶液时需将
溶液时需将![]() 溶解在盐酸中,故错误; 所以①②③④⑤都错误;
溶解在盐酸中,故错误; 所以①②③④⑤都错误;
选D。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】不饱和酯类化合物在药物、涂料等应用广泛。
(1)下列有关化合物 I 的说法,正确的是____(填字母编号)。
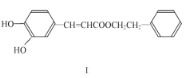
A.遇 FeCl3溶液可能显紫色
B.可发生酯化反应和银镜反应
C.能与溴发生取代和加成反应
D.1mol 化合物 I 最多能与 2molNaOH 反应
(2)反应①是一种由烯烃直接制备不饱和酯的新方法,化合物 II 的分子式为___________。
![]()
(3)化合物 II 可由芳香族化合物 III 或 IV 分别通过消去反应获得,但只有化合物 III 能与 Na 反应产生H2,化合物III的结构简式为___________(任写1种);由化合物IV生成化合物II的反应条件为___________ 。
(4)聚合物 可用于制备涂料,其单体结构简式为_______________。利用类似反应①的方法,仅以乙烯为有机物原料合成该单体,涉及的两个反应方程式为:
可用于制备涂料,其单体结构简式为_______________。利用类似反应①的方法,仅以乙烯为有机物原料合成该单体,涉及的两个反应方程式为:
Ⅰ. CH2=CH2+ H2O![]() CH3CH2OH
CH3CH2OH
Ⅱ.____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行X2(g)+3Y2(g)![]() 2Z(g)的反应,其X2、Y2、Z的起始浓度依次为0.1 mol/L、0.3 mol/L、0.2 mol/L,当反应达平衡时,各物质的浓度有可能的是 ( )
2Z(g)的反应,其X2、Y2、Z的起始浓度依次为0.1 mol/L、0.3 mol/L、0.2 mol/L,当反应达平衡时,各物质的浓度有可能的是 ( )
A.c(Z)=0.5 mol/LB.c(Z)=0.4 mol/L
C.c(X2)=0.2 mol/L或c(Y2)=0.6 mol/LD.c(Y2)=0.5 mol/L或c(X2)=0.15 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) ![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.15 mol·L-1·s-1 ②v(B)=0.6 mol·L-1·s-1;③v(C)=0.4 mol·L-1·s-1;④v(D)=0.45 mol·L-1·s-1该反应进行的快慢顺序为( )
2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.15 mol·L-1·s-1 ②v(B)=0.6 mol·L-1·s-1;③v(C)=0.4 mol·L-1·s-1;④v(D)=0.45 mol·L-1·s-1该反应进行的快慢顺序为( )
A.④>②=③>①B.④>②>③>①
C.①>②=③>④D.①>②>③>④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二胺![]() ,无色液体,有类似氨的性质。已知:
,无色液体,有类似氨的性质。已知:![]() 时,
时,![]() ,
,![]() ;乙二胺溶液中各含氮微粒的分布分数
;乙二胺溶液中各含氮微粒的分布分数![]() 平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数
平衡时某含氮微粒的浓度占各含氮微粒浓度之和的分数![]() 随溶液pH的变化曲线如图。下列说法错误的是
随溶液pH的变化曲线如图。下列说法错误的是
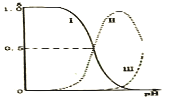
A.![]() 在水溶液中第一步电离的方程式为:
在水溶液中第一步电离的方程式为:![]()
B.曲线Ⅰ代表的微粒符号为![]()
C.曲线Ⅰ与曲线Ⅱ相交点对应![]()
D.在![]()
![]() 溶液中各离子浓度大小关系为
溶液中各离子浓度大小关系为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列事实所得出的解释或结论正确的是
选项 | 实验事实 | 解释或结论 |
A | 已知 | 金刚石比石墨稳定 |
B |
| 这是一个熵增反应 |
C | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的转化率一定增大 |
D | 用醋酸作导电性实验时,灯泡很暗 | 说明醋酸是弱酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,H2SO3的电离常数:Ka1=1.54×10-2,Ka2=1×10-7.向m mL0.1mo1L-1H2SO3溶液中滴加0.1molL-1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示,下列说法正确的是( )
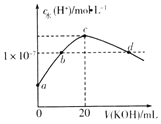
A.m=20
B.c点对应的溶液中存在c(K+)=c(HSO3-)+2c(SO32-)
C.b、d两点溶液的pH=7
D.SO32-+H2OHSO3-+OH-的Kb=1×10-7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:![]() 石墨
石墨![]()
![]()
![]() 石墨
石墨![]()
则4Fe![]() ______
______
(2)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图1所示:用Z表示的反应速率为______![]() ,写出该反应的化学方程式______,又反应开始到10s时,Y的转化率为______。
,写出该反应的化学方程式______,又反应开始到10s时,Y的转化率为______。

(3)图2为乙烷![]() 燃料电池的装置
燃料电池的装置![]() 、B为多孔碳棒
、B为多孔碳棒![]() :______
:______![]() 填A或
填A或![]() 处电极入口通乙烷,其电极反应式为______。
处电极入口通乙烷,其电极反应式为______。
(4)用中和滴定法测定溶液碱溶液的浓度。
①滴定时,用![]() 的盐酸来滴定待测溶液,若选用甲基橙作指示剂,滴定终点的判断方法是______。
的盐酸来滴定待测溶液,若选用甲基橙作指示剂,滴定终点的判断方法是______。
②下列操作![]() 其他操作正确
其他操作正确![]() 造成测定结果偏低是______
造成测定结果偏低是______
A.滴定终点读数时俯视读数
B.酸式滴定管使用前水洗后未用标准盐酸溶液润洗
C.锥形瓶水洗用待测液润洗
D.酸式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com