
| A. | Al2O3熔点很高,工业上还可采用电解熔融AlCl3的方法冶炼Al | |
| B. | 灼烧某物质时,用眼直接观察到火焰呈黄色,则可判断该物质不含钾元素 | |
| C. | 向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 | |
| D. | 称取等质量的两份铝粉,分别加入过量的稀HCl和过量的NaOH溶液中,则放出氢气的体积(同温同压下)不相等 |
分析 A.氯化铝是共价化合物,熔融状态下不导电;
B.K元素的焰色反应必须透过蓝色钴玻璃观察;
C.硫酸亚铁和NaOH反应生成氢氧化亚铁白色沉淀,但氢氧化亚铁沉淀不稳定,易被氧化生成红褐色氢氧化铁沉淀;
D.相同质量的铝分别与过量稀盐酸、NaOH溶液反应生成氢气,根据转移电子判断生成气体相同条件下体积是否相等.
解答 解:A.氯化铝是共价化合物,熔融状态下不导电,所以工业上不能采用电解熔融氯化铝方法冶炼铝,故A错误;
B.K元素的焰色反应必须透过蓝色钴玻璃观察,故B错误;
C.硫酸亚铁和NaOH反应生成氢氧化亚铁白色沉淀,但氢氧化亚铁沉淀不稳定,易被氧化生成红褐色氢氧化铁沉淀,氢氧化亚铁、氢氧化铁混合物颜色为灰绿色,所以整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀,故C正确;
D.相同质量的铝分别与过量稀盐酸、NaOH溶液反应生成氢气,这两个反应中只有Al作还原剂,铝的质量相等则失去电子物质的量相等,所以生成气体相同条件下体积相等,故D错误;
故选C.
点评 本题考查金属冶炼、氢氧化亚铁的制备、化学方程式的计算、焰色反应等知识点,明确物质性质、焰色反应、金属活泼性强弱与冶炼方法的关系即可解答,易错选项是D,注意D中根据转移电子相等判断即可,如果是稀盐酸和NaOH的物质的量相等,与足量Al反应则产生气体相同条件下NaOH的多,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 | |
| D. | 物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
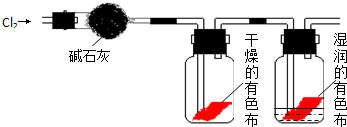
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
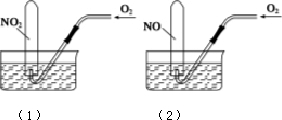 如图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体.假设试管内的溶质不向水槽中扩散,则(1)和(2)两个试管内溶质物质的量浓度之比为( )
如图所示,相同条件下,两个容积相同的试管分别装满NO2和NO气体,分别倒置于水槽中,然后通过导管缓慢通入氧气,边通边慢慢摇动试管,直到两个试管内充满液体.假设试管内的溶质不向水槽中扩散,则(1)和(2)两个试管内溶质物质的量浓度之比为( )| A. | 1:1 | B. | 5:7 | ||
| C. | 7:5 | D. | 4:3 (1)(2) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 系统法命名:2,4-二甲基-3-乙基己烷.
系统法命名:2,4-二甲基-3-乙基己烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4的电子式 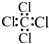 | B. | 苯的分子比例模型  | ||
| C. | 乙烯的结构式 CH2=CH2 | D. | 纤维素的分子式 C6H10O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能溶于水,但溶解性都比乙醇的差 | |
| B. | 都能与金属钠反应放出氢气 | |
| C. | 苯酚是比碳酸更强的酸,环己醇则显中性 | |
| D. | 苯酚与FeCl3溶液作用显紫色,环乙醇加入FeCl3溶液中无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com