
【题目】已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=8.0×10-38,Kb(NH3·H2O)=1.8×10-5,下列叙述中不正确的是
A.25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀
B.25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂
C.25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强
D.25℃时,![]() +H2O
+H2O![]() NH3·H2O+H+的平衡常数为5.6×10-10
NH3·H2O+H+的平衡常数为5.6×10-10
【答案】C
【解析】
A、假设镁离子和铁离子的浓度为0.01mol/L,依据溶度积可以计算出形成两种沉淀时需要的氢氧根离子浓度,形成氢氧化铁所需要的氢氧根离子浓度小,正确,不选A;
B、氯化镁溶液中有少量氯化铁,可以加入氧化镁进行除杂,利用了氧化镁消耗氯化铁水解生成的氢离子,促进氯化铁水解生成氢氧化铁,同时氧化镁转化成氯化镁,不引入新的杂质,正确,不选B;
C、加大量水稀释氨水,促进氨水的电离平衡正向移动,电离程度增大,但由于加入大量水,导致溶液体积变大,铵根离子浓度和氢氧根离子浓度降低,溶液导电能力减弱,错误,选C;
D、常温下,铵根离子水解平衡常数和氨水的电离平衡常数的乘积等于水的离子积,正确,不选D。


科目:高中化学 来源: 题型:
【题目】将适量的蔗糖(C12H22O11)放入烧杯,滴入几滴水,搅拌均匀,然后加入适量的浓硫酸。可观察到固体变黑,片刻后,黑色物质急剧膨胀,同时产生大量刺激性气味的气体,放出大量的热。(如下图所示)

(1)固体变黑体现了浓硫酸的________性(填“吸水”、“脱水”或“强氧化”)。
(2)确定刺激性气味气体的成分。
①将气体通入品红溶液后,溶液褪色,加热,颜色恢复。说明该气体中一定含有______。
②将气体通入澄清石灰水,溶液变浑浊,______(填“能”或 “不能”)证明气体中含有二氧化碳,其理由是________________。
③刺激性气味气体产生的原因可用如下化学方程式表示,完成化学方程式:_________。
(3)大量燃煤会产生与上述混合气体相同的废气,不仅污染空气还可能导致__________,请你提出至少一条防治措施____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
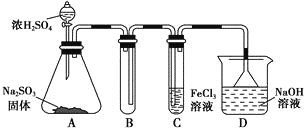
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在________中,再加水稀释,这样操作的目的是________,操作中不需要的仪器有________(填入正确选项前的字母)。
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时,C中观察到的现象为______________________________。
(3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:___________________________;
②请设计实验方案检验有Fe2+生成:__________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法________(填“合理”或“不合理”),理由是_______________________________________________________________。
(4)D装置中倒置漏斗的作用是______________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填入正确选项前的字母)。
a.浓H2SO4b.酸性KMnO4溶液
c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是分离混合物时常用的仪器,回答下列问题:
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]() E.
E. 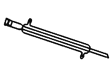
(1)写出仪器 C、E 的名称_____ 、_____。
(2)分离以下混合物应该主要选用上述什么仪器(填字母符号)a.粗盐和泥沙:____b.花生油和水:____
(3)下列实验与物质微粒大小无直接关系的是_____
A.过滤 B.渗析
B.渗析 C.萃取
C.萃取 D.丁达尔效应
D.丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Ba2+、NH4+、SO42-、CO32-、Cl-中的几种离子:
①取V mL的溶液滴加足量的 BaCl2 溶液,过滤,得到4.30g白色沉淀,往白色沉淀中加入足量的盐酸,沉淀部分溶解,余下2.33g沉淀未溶解;往滤液中滴加足量的AgNO3溶液,生成白色沉淀0.45mol。
②另取原溶液 V mL 与足量的 NaOH固体共热,生成气体 1.12 L(标准状况下)。
根据以上实验,回答下列问题:
(1)溶液中一定存在的阴离子有_____________
(2)溶液中不能确定存在的离子有 _____
(3)实验②发生反应的离子方程式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是
A.V=224B.样品中Fe的质量为2.14g
C.样品中CuO的质量为3.52 gD.未氧化前Fe元素的质量分数约为41.2%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,HNO2和CH3COOH的电离常数分別为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
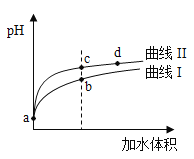
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中![]() 保持不变(其中HA、A-分别代表相应的酸和酸根离子)
保持不变(其中HA、A-分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下含碳各微粒H2CO3、HCO3-和CO32-存在于CO2和NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图所示,下列说法错误的是( )

A. 为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间
B. pH=10.25时,c(Na+)=c(CO32-)+c(HCO3-)
C. 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37
D. 若是0.1mol NaOH反应后所得的1L溶液,pH=10时,溶液中存在以下关系: c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____________________(填字母)。
A.c(H+) B.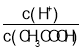 C.c(H+)c(OH﹣) D.
C.c(H+)c(OH﹣) D.![]() E.
E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:______________________。
(4)25℃时,将a mol/L的醋酸与等浓度的氢氧化钠等体积混合,反应后溶液中的离子浓度由大到小关系是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com