
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
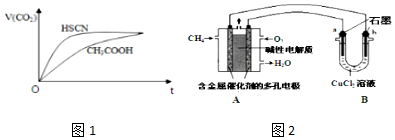
分析 (1)①据弱酸的电离平衡常数,判断弱酸的酸性强弱,越弱越水解,电离程度越大,溶液pH越大,据此分析;
②由生成二氧化碳的曲线斜率可知HSCN反应较快,则可知HSCN中中c(H+)较大,说明HSCN酸性较强,再利用盐类水解的规律来分析离子浓度的关系;
③若保持温度不变,在醋酸溶液中加入一定量氨气,消耗氢离子,氢离子的浓度减小,醋酸电离平衡正向移动,由此分析解答;
(2)①相同条件下,不同气体的摩尔质量之比等于其密度之比,据此计算氮氧化物平均摩尔质量,再根据平均摩尔质量计算NO和二氧化氮的物质的量之比;
②根据盖斯定律确定甲烷和二氧化氮之间的方程式,根据甲烷和NO、NO2之间的反应确定分别和NO、NO2之间反应需要甲烷的物质的量之比,再根据焓变进行计算;③NO气体可以分解为NO2气体和N2气体,反应的方程式为:4NO(g)=2NO2(g)+N2(g),由反应CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g),△H1;CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g),△H2;根据盖斯定律,△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$;
(3)①甲烷燃料碱性电池中,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水生成氢氧根离子;
②电解池中,阴极上电极反应式为Cu 2++2e-=Cu,阳极上电极反应式为2Cl--2e-=Cl2↑,根据串联电路中转移电子相等计算析出铜的质量.
解答 解:(1)①据弱酸的电离平衡常数可知,酸性HSCN>CH3COOH>H2CO3>HCN>HCO3-,酸性越弱,其酸根离子的水解程度越大,溶液pH越大,所以等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为c b d a,故答案为:c b d a;
②由Ka(CH3COOH)=1.8×10-5和Ka(HSCN)=0.13可知,CH3COOH的酸性弱于HSCN的,即在相同浓度的情况下HSCN溶液中H+的浓度大于CH3COOH溶液中H+的浓度,浓度越大反应速率越快;又酸越弱,反应生成的相应的钠盐越易水解,即c(CH3COO-)<c(SCN-),
故答案为:HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;<;
③若保持温度不变,在醋酸溶液中加入一定量氨气,消耗氢离子,氢离子的浓度减小,醋酸电离平衡正向移动,
a.平衡正向移动,体积不变,c(CH3COO-)变大,故不符合;
b.氨气消耗氢离子,使c(H+)减小,故符合;
c.Kw是温度的函数,温度不变,Kw不变,故不符合;
d.醋酸电离平衡常数是温度的函数,温度不变,所以醋酸电离平衡常数不变,故不符合;
故选:b;
(2)①在相同条件下对H2的相对密度为17的NO与NO2的混合气体,相同条件下,气体的密度之比等于其摩尔质量之比,所以混合气体的摩尔质量为34g/mol,设n(NO)为x,n(NO2)为y,混合气体摩尔质量=$\frac{30xg+46yg}{(x+y)mol}$=34g/mol,x:y=3:1,故答案为:3:1;
②16g甲烷的物质的量=$\frac{16g}{16g/mol}$=1mol,
根据盖斯定律知,CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H1
CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g);△H=0.5(△H1+△H2)
NO和NO2的物质的量之比为3:1,根据方程式知,当NO和NO2完全转化为氮气时,分别和NO、NO2反应的甲烷的物质的量之比=$\frac{3}{4}$:$\frac{1}{2}$=3:2,则有0.6mol甲烷和NO反应、0.4mol的甲烷和NO2反应,0.6mol甲烷和NO反应放出的热量=0.6mol×1160kJ/mol=696kJ,0.4mol甲烷和NO2完全反应放出的热量=1042.8kJ-696kJ=346.8kJ,则0.4mol甲烷和NO2完全反应放出的热量=0.5(△H1+△H2)×0.4mol=
=0.2mol×(1160kJ/mol+△H2)=346.8kJ,则△H2=-$\frac{346.8kJ}{0.2mol}$=-574 kJ/mol,
故答案为:-574 kJ/mol;
③NO气体可以分解为NO2气体和N2气体,反应的方程式为:4NO(g)=2NO2(g)+N2(g),由反应CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g),△H1;CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g),△H2;根据盖斯定律,△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$=-293KJ/mol,所以热化学方程式为:4NO(g)=2NO2(g)+N2(g)△H=-293KJ/mol,故答案为:4NO(g)=2NO2(g)+N2(g)△H=-293KJ/mol;
(3)①甲烷碱性燃料电池中,负极上电极反应式为CH4-8e-+10OH-=CO32-+7H2O,正极上电极反应式为O2+2H2O+4e-=4OH-,故答案为:CH4-8e-+10OH-=CO32-+7H2O;
②电解池中,阴极上电极反应式为Cu 2++2e-=Cu,阳极上电极反应式为2Cl--2e-=Cl2↑,连接原电池负极的是阴极,所以B中析出金属的是b电极,当A中消耗0.15mol氧气时,转移电子的物质的量=0.15mol×4=0.6mol,n(Cu 2+ )=2mol/L×0.05L=0.1mol,铜离子完全析出需要0.2mol电子,串联电路中转移电子相等,b电极上析出铜和氢气,所以析出铜的质量=0.1mol×64g/mol=6.4g,
故答案为:b;6.4.
点评 本题考查较综合,涉及原电池和电解池原理、弱电解质电离、盖斯定律等知识点,明确弱电解质的电离常数与酸根离子水解程度之间的关系、盖斯定律、原电池和电解池原理即可解答,注意(2)中分别与NO、NO2反应的甲烷的物质的量,(3)中阴极上不仅铜离子放电氢离子也放电,不能单纯根据转移电子相等计算析出铜的质量,为易错点.


科目:高中化学 来源: 题型:解答题
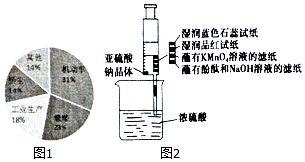 晋中市气象台2017年1月7日11时35分发布了雾霾黄色预警,随后晋中市发布了机动车限行通告.通过调查发现,形成雾霾的污染来源如图1所示.主要是机动车排放物和燃煤废气,其中会有大量的NOx和SO2.
晋中市气象台2017年1月7日11时35分发布了雾霾黄色预警,随后晋中市发布了机动车限行通告.通过调查发现,形成雾霾的污染来源如图1所示.主要是机动车排放物和燃煤废气,其中会有大量的NOx和SO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 气体的总体积 | ||
| C. | 混合气体的相对分子质量 | D. | 气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 溶液 | 加入物质 | 对应的图象 |
| (1)饱和石灰水 | 通过量CO2气体 | |
| (2)氯化铝溶液 | 加入过量氨水 | |
| (3)MgCl2、AICl3的混合液 | 逐滴加入NaOH溶液至过量 | |
| (4)含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
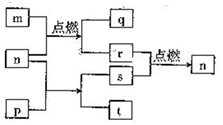 短周期主感元素X、Y、Z、W原子序数依次增大,W2+的电子层结构与氖相同,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种碱性氧化物,它们的关系如图所示( )
短周期主感元素X、Y、Z、W原子序数依次增大,W2+的电子层结构与氖相同,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种碱性氧化物,它们的关系如图所示( )| A. | Y、Z、W的简单离子半径:W>Z>Y | B. | 最高价氧化物的水化物的碱性:Z>W | ||
| C. | 简单气态氢化物的热稳定性:X>Y | D. | Y与Z形成的化合物中不含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
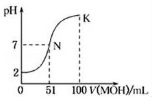 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )| A. | HA为一元强酸,MOH为一元弱碱 | |
| B. | N点溶液中离子浓度大小关系为:c(M+)=c(A-)>c(H+)=c(OH-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | N→k之间曲线上任意一点都有c(M+)>c(OH-)>c(A-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
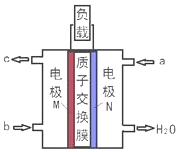 甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇燃料电池的总反应式2CH4O+3O2═2CO2+4H2O,下图是该燃料电池的示意图.下列说法正确的是( )
甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇燃料电池的总反应式2CH4O+3O2═2CO2+4H2O,下图是该燃料电池的示意图.下列说法正确的是( )| A. | a是甲醇燃料、b是氧气 | |
| B. | 当转移6mol e-时,消耗33.6L O2 | |
| C. | 负极反应:CH4O-6e-+H2O═CO2↑+6H+ | |
| D. | 质子从N电极区穿过交换膜移向M电极区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com