
【题目】阅读下列实验内容,根据题目要求回答问题:
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果_____________(填“偏小”、“偏大”或“无影响”)。
(2)配制稀H2SO4溶液,必须使用的主要容器是_________________。
(3)计算待测硫酸溶液的物质的量浓度(计算结果保留到小数点后第二位)___________。
(4)欲配制0.175mol/L醋酸钠溶液500mL,可采用以下两种方案:
方案一:用托盘天平称取_______g无水醋酸钠,溶于适量水中,配成500mL溶液。
方案二:用体积均为250 mL且浓度均为________的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
【答案】 偏大 100mL容量瓶 4.20mol/L 7.2 0.35mol/L
【解析】(1). 碱式滴定管用蒸馏水润洗后,未用标准液润洗,相当于标准液被稀释,所以消耗的标准液会增多,滴定结果偏大,故答案为:偏大;
(2). 配制100mL溶液必须用到100mL容量瓶,则配制稀H2SO4溶液,必须使用的主要容器是100mL容量瓶,故答案为:100mL容量瓶;
(3).根据反应2NaOH+H2SO4=Na2SO4+2H2O,稀释后的硫酸溶液浓度为:c(H2SO4)=(![]() ×0.14mol/L×0.015L)÷0.025L=0.042mol/L,则稀释前待测硫酸的浓度为:0.042mol/L×
×0.14mol/L×0.015L)÷0.025L=0.042mol/L,则稀释前待测硫酸的浓度为:0.042mol/L×![]() =4.20mol/L,故答案为:4.20mol/L;
=4.20mol/L,故答案为:4.20mol/L;
(4). 醋酸钠的物质的量为:n(CH3COONa)=c×V=0.175mol/L×0.5L=0.0875mol,m(CH3COONa)=0.0875mol×82g/mol=7.175g≈7.2g,所以:方案一:用托盘天平称取7.2g无水醋酸钠,溶于适量水中,配成500mL溶液;等体积混合,浓度会减小一半,所以方案二:用体积均为250 mL且浓度均为0.35mol/L的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和),故答案为:7.2; 0.35mol/L。


科目:高中化学 来源: 题型:
【题目】通过反应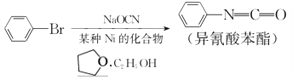 ,可制备有机中间体异氰酸苯酯。
,可制备有机中间体异氰酸苯酯。
(1) Ni3+基态核外电子排布式为________。
(2)异氰酸苯酯分子中碳原子杂化轨道类型是________,1 mol异氰酸苯酯分子中含有σ键数目为________。
(3)Na、O、C、N四种元素的第一电离能从大到小的顺序为_________________________。
(4) C2H5OH的沸点高于![]() ,这是因为__________________。
,这是因为__________________。
(5) Ni与Al形成的一种合金可用于铸造飞机发动机叶片,其晶胞结构如右图所示,该合金的化学式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) =2NO(g)+O2(g) (正反应吸热)。实验测得:v正= v(NO2)消耗= k正c2(NO2) v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法不正确的是
容器 编号 | 物质的平衡浓度(mol/L) | 物质的起始浓度(mol/L) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 温度为T1,反应达平衡时,容器Ⅲ中的平衡常数K=0.8
B. 达平衡时,速率常数和化学平衡常数的关系K= k正/k逆
C. 当温度改变为T2时,若k正=k逆则T21
D. 容器Ⅱ反应达平衡前,v正>v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如图所示。
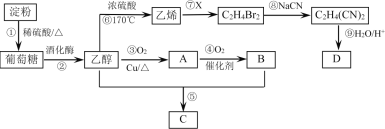
回答下列问题:
(1)淀粉的组成可表示为___________,A分子中的官能团名称为__________。
(2)反应⑦中物质X的分子式为________,反应⑧的类型为______________。
(3)反应⑤的化学方程式为________________________________________________。
(4)反应⑥可用于实验室制乙烯,为除去其中可能混有的SO2,可选用的试剂是________。
A.溴水 B.酸性KMnO4溶液 C. NaOH溶液 D.浓硫酸
(5)已知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的分子式为____________。
(6)为了证明反应①是否发生,可取①反应后的溶液2mL于一支试管中,用____调节溶液至中性,再向其中加入2 mL_____,再加入4~5滴_____(以上用如下所提供试剂的字母填空),加热一段时间,若有______________现象产生,则证明反应①已发生。
实验中可供选择的试剂:
A.10%的NaOH溶液 B.2%的氨水 C.5%的CuSO4溶液 D.碘水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实验科学,化学反应过程中的能量变化和速率变化是中学化学研究的重要内容
Ⅰ.利用如图所示装置测定中和热
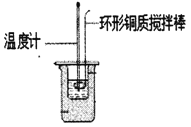
(1)图中明显有一处错误,请指出___________
(2)________(填“能”或“不能”)用Ba(OH)2 溶液和硫酸代替氢氧化钠溶液和盐酸进行中和热测定
Ⅱ.探究硫酸铜的量对氢气生成速率的影响。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需的时间。
实验 混合溶液 | A | B | C | D | E | F |
4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
(1) 请完成此实验设计,其中: V8=_________
(2) 当CuSO4溶液少量时,反应速率明显加快,原因_______
(3) 当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作过程中实验现象的变化只有一次的是( )
A.石蕊试液中逐滴滴加氯水
B.酚酞试液中加入过氧化钠固体
C.氢氧化铁胶体中逐滴滴加硫酸
D.碳酸钠溶液中逐滴滴加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PEI [ ]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):
]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):

已知:
(1)A为链状烃。A的化学名称为______。
(2)A→B的反应类型为______。
(3)下列关于D的说法中正确的是______(填字母)。
a.不存在碳碳双键
b.可作聚合物的单体
c.常温下能与水混溶
(4)F由4-氯-1,2-二甲苯催化氧化制得。F所含官能团有-Cl和______。
(5)C的核磁共振氢谱中,只有一个吸收峰。仅以2-溴丙烷为有机原料,选用必要的无机试剂也能合成C写出有关化学方程式:______。
(6)F→K 的反应过程中有多种副产物。其中一种含有3个环的有机物的结构简式是___。
(7)以E和K为原料合成PEI分为三步反应。

写出中间产物1、中间产物2的结构简式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】巳知:25℃时某些弱酸的电离平衡常数。下面图像表示常温下稀释CH3COOH、HClO两种酸的稀溶液时、溶液pH随加水量的变化,下列说法正确的是
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-3 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
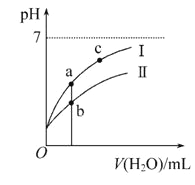
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a点酸的总浓度大于b点酸的总浓度
D. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com