
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
分析 A.铁离子与铜反应生成亚铁离子和铜离子;
B.2mol过氧化钠与水反应生成1mol氧气,该反应不满足电子守恒;
C.次氯酸为弱酸,离子方程式中次氯酸不能拆开;
D.酸性高锰酸根离子能够氧化氯离子,干扰了检验结果.
解答 解:A.用FeCl3溶液腐蚀铜线路板,反应生成氯化亚铁和氯化铜,反应的离子方程式为:Cu+2Fe3+═Cu2++2Fe2+,故A正确;
B.Na2O2与H2O反应制备O2,正确的离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,故B错误;
C.将氯气溶于水制备次氯酸,次氯酸应该保留分子式,正确的离子方程式为:Cl2+H2O═H++Cl-+HClO,故C错误;
D.酸性高锰酸钾能够氧化盐酸中的氯离子,无法证明H2O2具有还原性,应该用浓硝酸或浓硫酸酸化,故D错误;
故选A.
点评 本题考查了离子方程式的判断,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:推断题
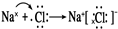
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
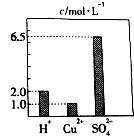 在0.2L由H2SO4、CuSO4和Al2(SO4)3组成的混合溶液中,部分离子浓度大小如图所示,请回答下列问题:
在0.2L由H2SO4、CuSO4和Al2(SO4)3组成的混合溶液中,部分离子浓度大小如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

组号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/ml | c/mol•L-1 | V/ml | c/mol•L-1 | V/ml | ||
| A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | a |
| C | 30 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
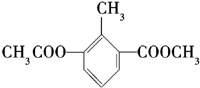
| A. | 一个分子中含有12个H原子 | B. | 苯环上的一氯代物有2种 | ||
| C. | 含有一种含氧官能团 | D. | 分子式是C11H12O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互为手性异构体的分子互为镜像 | |
| B. | 利用手性催化剂合成可主要得到一种手性分子 | |
| C. | 手性异构体分子组成相同 | |
| D. | 手性异构体性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
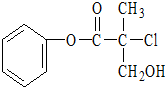 某有机物A是农药生产中的一种中间体,其结构简式如图所示:下列关于A的叙述正确的是( )
某有机物A是农药生产中的一种中间体,其结构简式如图所示:下列关于A的叙述正确的是( )| A. | 属于卤代烃,易溶于水 | |
| B. | 在酸性或碱性条件下都能发生水解反应 | |
| C. | 1molA可以与2molNaOH反应 | |
| D. | 一定条件下可发生加成反应和消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂 | 操作方法 |
| A | 二氧化碳 | 一氧化碳 | 氢氧化钠溶液和浓硫酸 | 洗气 |
| B | 硫酸钡 | 碳酸钡 | 足量的稀硫酸 | 溶解、过滤、洗涤、烘干 |
| C | 氯化钙溶液 | 消石灰 | 过量的二氧化碳 | 过滤、蒸发、结晶 |
| D | 氨气 | 水 | 火碱溶液 | 通过盛有火碱溶液的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气在光照条件下反应产生油状液滴 | |
| B. | 乙烯能使溴的四氯化碳溶液褪色 | |
| C. | 苯能使酸性高锰酸钾溶液褪色 | |
| D. | 乙醇可以和金属钠反应放出氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com