
已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
| A.c(H+) | B.c(H+)/ c(CH3COOH) | C.c(H+)·c(OH-) | D.c(OH-)/ c(H+) |

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
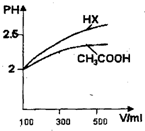 已知25℃时部分弱电解质的电离平衡常数数据如下表:
已知25℃时部分弱电解质的电离平衡常数数据如下表:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液;
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
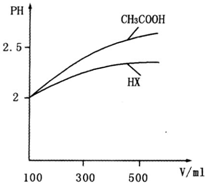
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)= mol·L-1(填精确值)。
(5)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c (OH-)=2c(H2CO3)+ ;
②c(H+)+c(Na+)= 。
查看答案和解析>>
科目:高中化学 来源:2014届江苏省高二5月学分认定模块检测化学试卷(解析版) 题型:填空题
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
|
化学式 |
CH3COOH |
H2CO3 |
HClO |
|
|
电离平衡常数 |
Ka=1.8×10-5 |
Kal=4.3×10-7 |
Ka2=5.6×10-11 |
Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液;
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E.c(H+)·c(CH3COO-)/c(CH3COOH)
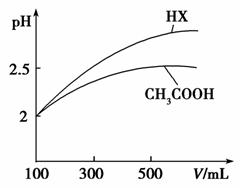
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数_____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中
c(CH3COO-)-c(Na+)= mol·L-1(填精确值)。
(5)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c (OH-)=2c(H2CO3)+ ;
②c(H+)+c(Na+)= 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年天津市高三第二次模拟考试(理综)化学部分 题型:填空题
(14分)已知25℃时部分弱电解质的电离平衡常数数据如下表:

回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO d.NaHCO3;pH由小到大的排列顺序是 (用字母表示)
(2)常温下,0.1mol·L-1的CH3COOH溶液加稀释过程中,下列表达式的数据变大的是
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
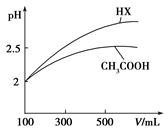
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示
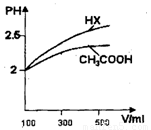
则HX的电离平衡常数 CH3COOH的电离平衡常数(填大于、小于或等于)理由是
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)—c(Na+)= mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com