
分析 (1)在水溶液或者熔融状态下能够导电的化合物是电解质;在水溶液和熔融状态下都不导电的化合物是非电解质;
(2)氯化镁为强电解质,完全电离;
(3)铁与水蒸气在高温条件下反应生成四氧化三铁和氢气.
解答 解:(1)①铁是单质,不是电解质; ②稀硫酸是混合物不是电解质; ③氯化氢水溶液能够导电,是化合物,属于电解质; ④氨气本身不能电离,属于非电解质; ⑤空气是混合物,不是电解质; ⑥二氧化碳本身不能电离,属于非电解质;⑦水银是单质,不是电解质; ⑧氯化镁在水溶液或者熔融状态下能够导电的化合物是电解质; ⑨硫酸钡熔融状态下能够导电的化合物,属于电解质; ⑩蔗糖在水溶液和熔融状态下都不导电的化合物是非电解质;
所以属于电解质的是③⑧⑨;
故答案为:③⑧⑨;
(2)氯化镁为强电解质,完全电离,电离方程式:MgCl2=Mg2++2Cl-;
故答案为:MgCl2=Mg2++2Cl-;
(3)铁与水蒸气在高温条件下反应生成四氧化三铁和氢气,离子方程式:3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
故答案为:3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
点评 本题考查了电解质的判断、电离方程式、化学方程式的书写,明确电解质的概念及电解质电离方式是解题关键,注意单质和化合物既不是电解质也不是非电解质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:4 | C. | 1:2:3 | D. | 1:3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g) 在反应中被氧化为1mol SO3(g) 的△H=-99kJ/mol.回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g) 在反应中被氧化为1mol SO3(g) 的△H=-99kJ/mol.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
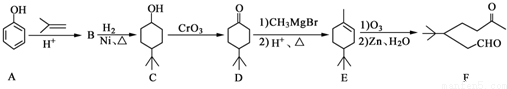
 .
. .同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基.
.同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基. (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
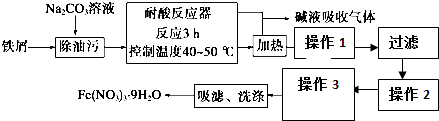
| 物质 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 2.6×10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2与足量潮湿的CO2反应,转移的电子数为0.1 NA | |
| B. | 标准状况下2.24 L HCHO中含0.4 NA个原子 | |
| C. | 23.4g NaCl晶体中含0.1 NA个如图所示结构单元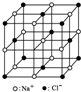 | |
| D. | 4.0gSiC晶体中含有的共价键数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com