
| A. | 酸性:H2SO4>H2SO3 | B. | 氧化性:H2SO4(浓)>H2SO4(稀) | ||
| C. | 稳定性:CH4<SiH4 | D. | 碱性:Mg(OH)2>Al(OH)3 |
分析 A.一般情况下,元素的化合价越高,含氧酸的酸性越强;
B.浓度越大,氧化性越强;
C.非金属性越强,气态氢化物的稳定性越强;
D.金属性越强,最高价氧化物对应水化物的碱性越强.
解答 解:A.在H2SO4和H2SO3中,S的化合价依次为+6、+4,H2SO4是强酸,H2SO3是弱酸,酸性H2SO4>H2SO3,故A正确;
B.浓度越大,氧化性越强,氧化性:H2SO4(浓)>H2SO4(稀),故B正确;
C.非金属性C>Si,气态氢化物的稳定性CH4>SiH4,故C错误;
D.金属性Mg>Al,最高价氧化物对应水化物的碱性Mg(OH)2>Al(OH)3,故D正确;
故选C.
点评 本题考查元素周期律,侧重于学生的分析能力的考查,注意把握判断的角度,注重相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
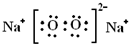 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

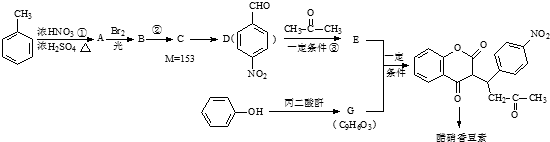

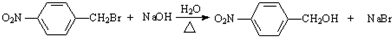 ;
;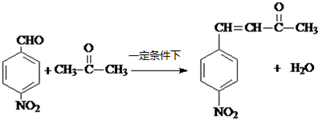 ;
;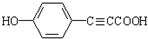 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
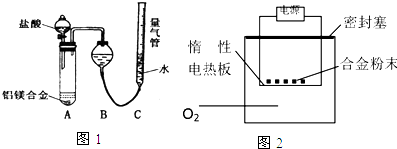
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | H-O | 464 |
| S=S | 255 | H-S | 339 | C-F | 427 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
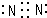 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8个中子的碳原子的核素符号:12C | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 氢氧根离子的电子式: | D. | Cl-离子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com