
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.15 | 0 |
| 平衡浓度/mol?L-1 | 0.01 | 0.105 | 0.09 |
| 已转化浓度 |
| 起始浓度 |
| △c(X) |
| △t |
| 0.09mol?L-1 |
| 2min |
| 已转化Y浓度 |
| Y起始浓度 |
| 0.045mol?L-1 |
| 0.15mol?L-1 |


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
| A、原子序数:X>Y |
| B、原子半径;X>Y |
| C、离子半径:Xn+>Ym- |
| D、离子半径:Xn+<Ym- |
查看答案和解析>>
科目:高中化学 来源: 题型:
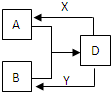 A、B、D、X、Y是由短周期元素组成的化合物,其中X是常见的强酸(如盐酸)、Y是常见的强碱(如氢氧化钠),它们的相互转化关系如右图(部分生成物和水略去).
A、B、D、X、Y是由短周期元素组成的化合物,其中X是常见的强酸(如盐酸)、Y是常见的强碱(如氢氧化钠),它们的相互转化关系如右图(部分生成物和水略去).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
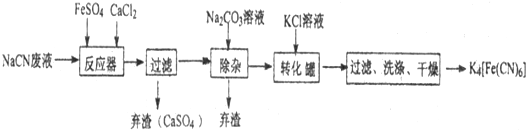
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜与稀硝酸的反应:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
| B、氯气与水反应:Cl2+H2O?H++Cl-+HClO |
| C、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com